JNCCN:T-ALL的基因组分类:当前现状和未来的生物标志物
18小时前 聊聊血液 聊聊血液 发表于威斯康星
在T-ALL中很少有哪些特征能够独立于治疗反应之外预测不良预后的风险。因此,大多数协作组不使用疾病生物学来进行T-ALL风险分层。
在过去的20年中,T淋巴细胞白血病/淋巴瘤(T-ALL)的长期治愈率从60%提高到65%再到80%,主要归功于化疗方案的强化。对于B淋巴细胞白血病/淋巴瘤(B-ALL),可通过风险分层改善预后,其整合临床和人口统计学特征、治疗反应以及疾病生物学,以识别更有可能或不太可能对传统治疗产生反应的患者,从而能够使用适应相对风险的方案。不幸的是,在T-ALL中很少有哪些特征能够独立于治疗反应之外预测不良预后的风险。因此,大多数协作组不使用疾病生物学来进行T-ALL风险分层。
最近多项T-ALL基因组计划提高了对疾病生物学的理解,增强了将T-ALL分类为不同生物学亚型的能力,并确定了预测预后的基因组改变,且这些改变独立于治疗反应。这些生物标志物包括:新定义的高危“ETP(早期T细胞前体)样”转录亚型,根据转录组学而非免疫表型特征重新对未成熟T-ALL进行分类;在复发/难治性(R/R)T-ALL中富集的治疗难治性“骨髓祖细胞样”白血病部分;内含子介导的非典型NOTCH1失调。将这些新的生物标志物整合到临床治疗中,有望为快速的前期风险分层提供信息,支持新的靶向治疗方案,并指导高危T-ALL的未来验证和临床前研究。
《Journal of the National Comprehensive Cancer Network》近日发表综述,强调了T-ALL 的分类和治疗中新出现的生物标志物。

T-ALL分类的首次威廉亚洲博彩公司 源自欧洲白血病国际分类小组(EGIL),根据表面免疫表型将T-ALL分为前T细胞、前T细胞/未成熟、皮质和成熟T-ALL亚型(表1)。在单变量分析中,皮质T-ALL具有更良好的预后;然而这种关联在多变量分析中并未得到重现,此外EGIL分类通常不用于风险分层。

2009年,Coustan - Smith等人首次根据其混合干细胞/髓系/早期T系免疫表型以及与小鼠早期T细胞前体的转录组相似性,描述了ALL的早期T细胞前体(ETP)亚型(ETP-ALL)。最初使用圣犹大儿童研究医院和di Ematologia e Oncologia Pediatrica队列的回顾性数据的出版物发现,ETP-ALL患者的生存结局非常差,治疗失败率高。最近来自儿童肿瘤学组(COG)AALL0434临床试验的数据(迄今为止报告T-ALL最佳已发表结果的国际3期试验)表明,ETP-ALL和非ETP-ALL的总生存期(OS)相似,但治疗失败的原因不同,ETP-ALL患者更有可能对诱导治疗产生耐药性,而非ETP-ALL患者更有可能达到缓解并复发。
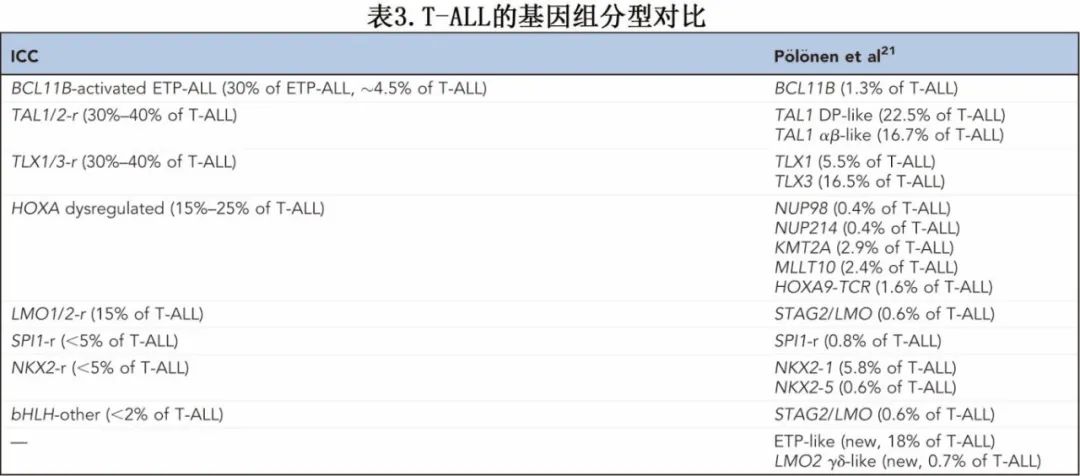
2022年WHO威廉亚洲博彩公司 根据免疫表型将T-ALL分为ETP-ALL和非ETP-ALL亚型(表2),而更新的T-ALL国际共识分类(ICC)将ETP-ALL进一步细分为BCL11B活化与非特指型(NOS)类别,并纳入由免疫表型和基因组特征定义的暂定亚型(表3)。对T-ALL的全面基因组特征分析阐明了免疫表型亚型背后的生物学驱动因素和转录表型,为将白血病表型与治疗反应和结果联系起来铺平了道路。正如以下部分所述,对AALL0434试验中患者的最新批量和单细胞基因组分析也阐明了ETP-ALL治疗耐药性的分子机制。

对人类T-ALL样本的首次基因组分析可以追溯到2002年,当时Ferrando等人使用微阵列和定量实时逆转录聚合酶链反应(RT - PCR)识别与HOX11、LYL1、TAL1和LMO1/2转录因子过表达(HOX11+、LYL1+、TAL1+、LMO1/2+)相关的阶段性特异性基因表达特征,首次从机制上揭示了不同的染色体驱动因素如何干扰正常的胸腺细胞分化和存活通路。LYL1+样本与未分化的胸腺细胞表型、高BCL2表达和不良预后相关,而HOX11+样本与早期皮质表型相关,TAL1+样本与晚期皮质表型相关。
Soulier等人、Van Vlierberghe等人和Homminga等人进一步进行的微阵列表达、断裂点聚类和染色体构象分析阐明了新的致癌驱动因素(TAL/LMO/TLX1、TLX3、HOXA、NKX2 - 1和MEF2C),导致新的遗传T-ALL亚组的分类。MEF2C和HOXA激活的T-ALL与未成熟胸腺细胞发育停滞相关,而TAL1/LMO和TXL1/3失调的T-ALL与T细胞发育后期的停滞相关。
2010年代的最新研究表明,表观遗传变化导致癌基因过表达;例如,使用CpG甲基化微阵列对T-ALL进行分类,将其分为CpG岛高甲基化(CIMP1)和低甲基化(CIMP2)表型,揭示了CIMP1 T-ALL与HOXA9/10、TLX1/3和NKX2 - 1癌基因过表达之间的关联。在CIMP2 T-ALLs中,TAL1启动子的低甲基化和融合断裂点分别与TAL1过表达和STIL::TAL1融合相关。
2021年,Montefiori等人描述了一组ETP-ALL和混合表型急性白血病病例,其特征是干细胞中由TCR增强子劫持介导的等位基因特异性BCL11B过表达。该研究识别了一种现在被ICC认可的ETP-ALL的独特亚型,并强调了发育不适当的T系决定转录因子失调的致癌潜力。染色体构象捕获和H3K27ac/H3K4me染色质免疫沉淀在表征以前未解决的失调机制(包括MEF2C1、TAL11和BCL11B激活的T-ALL)方面的高产量,突显了非编码癌基因激活在T-ALL中的重要性。
T-ALL儿童和年轻人的最佳结局来自COG AALL0434的nelarabine和Capizzimethotrexate组,这是一项国际3期随机试验,纳入1500多名1至31岁的T-ALL患者。患者接受增强型BFM方案治疗,第一次随机分配至剂量递增的甲氨蝶呤与大剂量甲氨蝶呤,第二次随机中高危患者接受额外nelarabine治疗。Liu等人于2017年发表了对AALL0434治疗的T-ALL患者的首次基因组分析,大约20%的患者接受了全外显子组测序(WES)和批量RNA测序(全转录组测序[WTS]),揭示了9种T-ALL亚型。这一初始基因组队列富含微小残留病(MRD)阴性患者,并且没有足够的统计学效力将基因组特征与结局联系起来。此外,全基因组测序(WGS)仅在极少数患者中进行,限制了对基因组非编码区域的研究。
这些研究局限性在最近完成的一项由P€ol€onen等人进行的研究中得到了解决,该研究对AALL0434试验中接受治疗的1300多名患者使用肿瘤细胞的WGS、WES和WTS以及健康正常细胞的WGS进行了分析。通过使用治疗1个月后的外周血或来自外周有白血病细胞患者的排序骨髓样本(作为生殖系DNA的来源),将患有难治性疾病的患者纳入研究。这项开创性的研究根据遗传驱动因素、转录组相似性和发育停滞阶段,确定了15种T-ALL基因组亚型(其中2种为新发现)(图1A)。许多新发现的遗传病变涉及多种基因组区域的增强子劫持,这些区域汇聚到先前定义的表型上。例如,在TLX31 T-ALL(通常由BCL11B增强子劫持驱动)中发现了TCRB、CDK6和MYC的重排,而在NKX2 - 1激活的病例中(通常通过TCRd重排实现)发现了14号染色体的染色体碎裂、基因间丢失和增强子获得。将遗传亚型映射到造血发育的健康单细胞图谱,也使得可以根据细胞谱系对每个亚型进行分类(图1B)。这种方法允许对常见亚型进行更精细的分类,例如TAL1 DP样(以前为TAL1 - RA)和TAL1 ab样(以前为TAL1 - RB)(基于它们与正常CD4/8双阳性和ab T细胞前体的相似性)。在新定义的T-ALL亚型中,有一组高危病例被称为“ETP样”,约占队列的18%。大约70%具有ETP免疫表型的病例属于基因组定义的ETP样组;然而ETP样组本身显示出ETP、近ETP和非ETP免疫表型病例的近乎相等的分布。ETP免疫表型病例也常见于BCL11B和TLX3亚型,而近ETP免疫表型病例也常见于TAL1 ab样和TLX3亚型。ETP样病例在转录组上与健康的骨髓祖细胞相似,与MRD阳性相关,并显示出较差的无事件生存期和总生存期(图1C)。
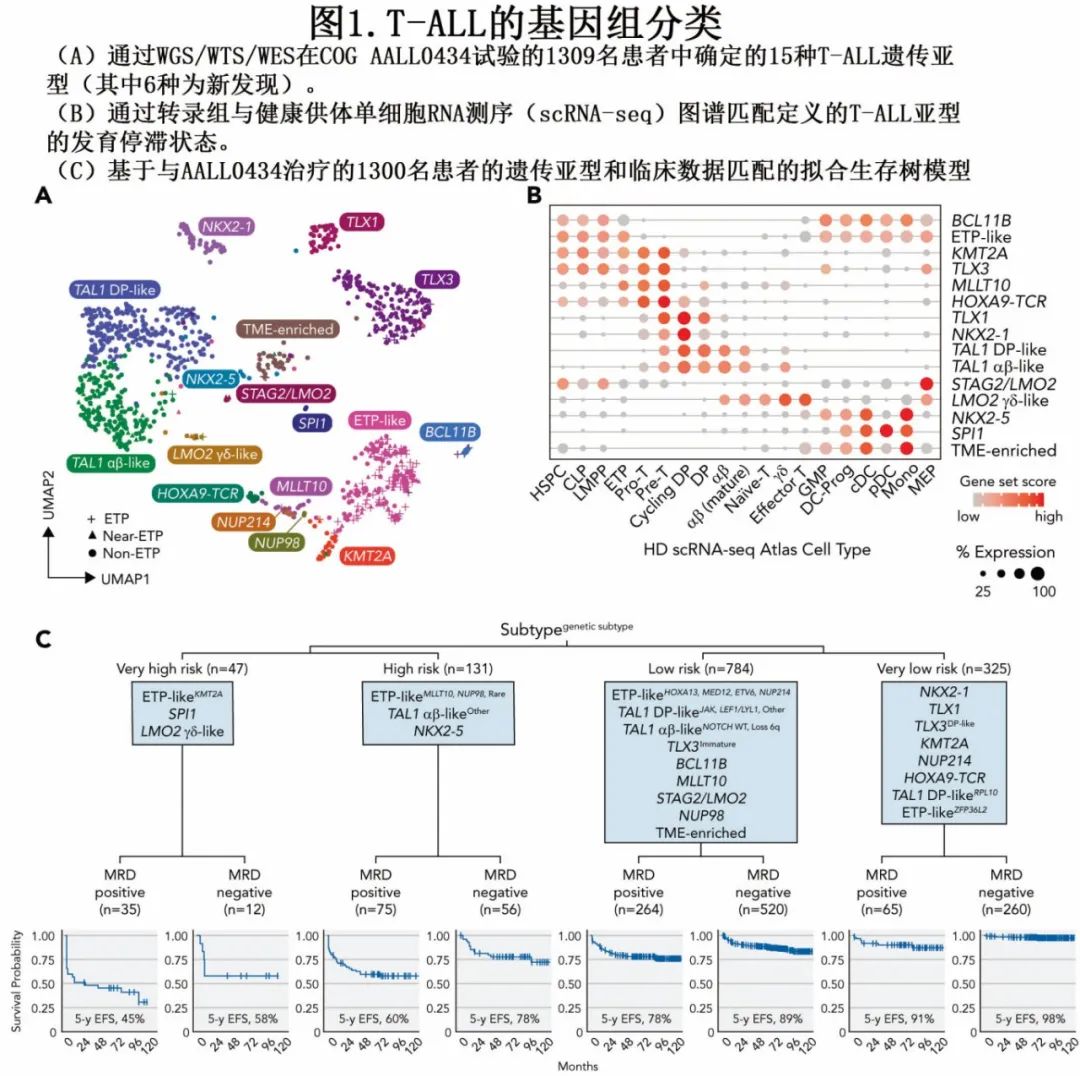
最近的单细胞(sc)基因组学研究也强调了肿瘤异质性是T-ALL治疗失败的机制。在P€ol€onen等人最近分析的AALL0434队列中,29.1%的患者在NOTCH1基因中存在多个激活突变,表明存在大量可能导致复发的肿瘤亚克隆。De Bie等人的初步工作使用scDNA测序分析了12名患者,研究了T-ALL中的亚克隆,显示出与治疗失败和复发相关的治疗耐药亚群的反复克隆选择。2021年,Anand等人使用scRNA测序分析了具有NOTCH1突变的ETP-ALL患者,识别出可通过磷脂酰肌醇3 - 激酶(PI3K)抑制靶向的γ -分泌酶抑制剂耐药亚群。Xu等人最近使用CITE - seq(通过测序的转录本和表位的细胞索引)和scATAC - seq(单细胞转座酶可及染色质测序)绘制了来自40名在AALL0434治疗的T-ALL患者的约60万个原始细胞的肿瘤图谱,将T-ALL原始细胞映射到T细胞发育的scRNA/scATAC - seq图谱中,识别出一种在治疗难治性T-ALL患者中共享的化疗/类固醇耐药的骨髓祖细胞样(BMP样)肿瘤群体(无论免疫表型如何)。BMP样原始细胞具有与胸腺定植祖细胞相似的转录组学特征,保留了高水平的干细胞和髓系基因以及表面标记表达,这些特征强有力地预测患者结局,独立于MRD和中枢神经系统疾病。
将BMP样和ETP样遗传特征整合起来有望通过基因表达、突变特征和表面免疫表型快速识别高风险患者。使用P€ol€onen等人的RNA测序数据得出的初步结果表明,BCL11B和ETP样亚型高度富含BMP样病例(“BMP -high”;图2A,B)。在ETP样亚型中,KMT2A - r病例中BMP - 高病例的比例最高,而ZFP36L2 - r病例中该比例最低,与拟合生存树模型中识别的极高危(ETP样/KMT2A)和极低危(ETP样/ZFP36L2)风险分组相一致(图2C)。其他具有HOXA簇激活的ETP样病例,如由NUP98/214、HOXA13和MLLT10融合驱动的病例,也具有较高比例的BMP样病例。生存分析表明,BMP样转录组学特征与ETP样遗传分类高度互补,进一步将高风险患者分层为不同的风险类别(图2D)。正在进行的对整个COG AALL1231队列的测序是一个新兴平台,可以独立验证这些发现并支持临床实施。
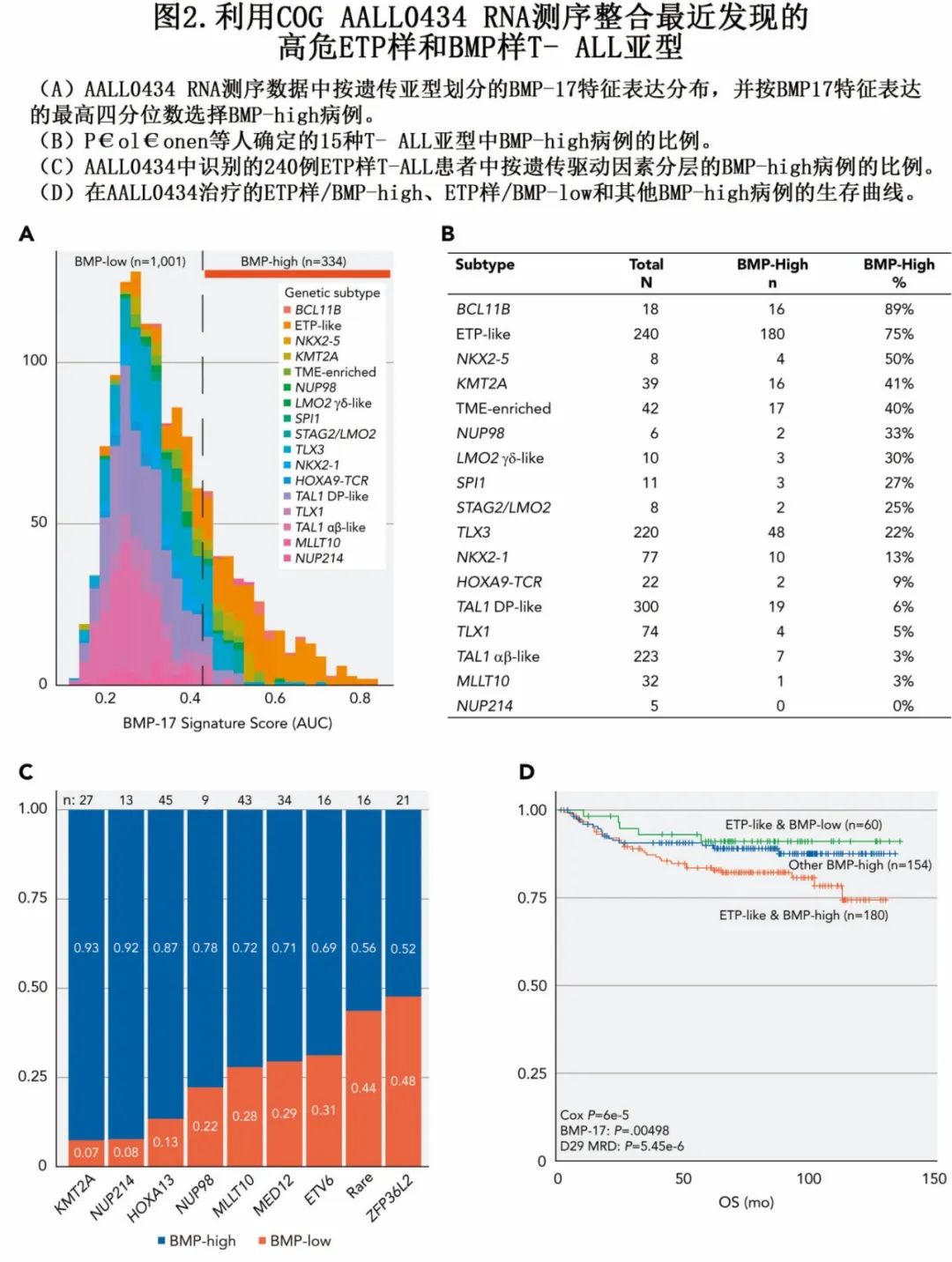
干细胞样祖细胞状态的发育停滞是实体瘤、髓系肿瘤和其他淋巴系癌症不良预后的标志。T-ALL中发育状态与治疗反应之间的最初联系是由Ferrando等人提出的,他们指出LYL11和TAL11 T-ALL亚组中BCL2和BCL2A1的过表达可能解释相对化疗耐药性。这些发现在研究中得到了支持,这些研究表明,早期胸腺细胞停滞(通过缺乏双等位基因TCRγ缺失来指示)与在COG P9404和DFCI 00 - 01研究中接受治疗的患者的诱导失败有关。2014年,Anderson等人指出,未成熟的T-ALL细胞系(如LOUCY)与成熟T-ALL细胞系相比,BCL2和BCLw表达上调,并且对维奈克拉具有独特的敏感性。
2022年,Lee等人分析了来自119名患者的T-ALL细胞对18种化疗药物和小分子抑制剂的药敏性,将分子亚型与药物反应和临床结果整合在一起。他们发现,T-ALL中持续的MRD与对靶向药物(包括panobinostat、达沙替尼和维奈克拉)的差异反应有关。该研究还通过LCK活化识别出大量T-ALL病例(更常见的是成熟T – ALL)对达沙替尼敏感,这与Serafin等人和Yoshimura等人的发现一致,最终证明了药物基因组学分析可以为R/R T-ALL患者识别靶向治疗。
基于突变状态,早期发育停滞与不良结果之间的联系也已被提出。例如,5基因GRAALL - 2003/2005风险分类器(NOTCH1、FBXW7、NRAS/KRAS和PTEN)表明,与祖细胞富集的突变(NRAS、KRAS、TP53)相比,具有成熟T细胞相关突变(NOTCH1、FBWX7)的患者预后更佳。最近发表的来自UKALL2003和UKALL2011试验的生殖系和诱导失败病例的WGS显示,诱导失败仅限于HOXA、TAL1、TLX3和LMO2/LYL1亚型,HOXA亚型和WT1突变病例显著富集,而TLX1/TAL2/NKX2 - 1亚型和NOTCH1/FBXW7突变病例则减少。对南印度队列的基因组分析也将未成熟T系转录因子MEF2C、HHEX和LYL1的高表达与不良预后联系起来。
ETP样和BMP样T-ALL的基因组识别提供了几条额外的证据,将早期发育停滞和治疗耐药性联系起来。单细胞转录组学表明,NR3C1表达与T细胞分化状态密切相关,提示祖细胞样原始细胞具有固有的类固醇耐药机制。其次,BMP样和ETP样T-ALL富含独特的突变谱,包括在髓系白血病中常见的造血调节基因中的驱动改变。最后,BMP样原始细胞的治疗敏感性特征与其他白血病干细胞相匹配,对传统细胞毒性药物表现出耐药性,对BCL2抑制剂表现出显著的敏感性。这些数据表明,基于遗传的分类可以更准确地识别具有未成熟T-ALL的高风险患者,以便分配到靶向治疗。
NOTCH信号通路是T-ALL中最常出现异常的通路。最初,NOTCH1基因突变是在携带t(7;9)易位的T-ALL病例中被发现的,这种易位将截短的NOTCH1基因与TCRβ基因座融合。初步模型研究表明,这些融合导致NOTCH1蛋白的胞外结构域被截短,进而引起非生理性的核内定位。1996年,Pear等人首次描述了NOTCH激活与T细胞肿瘤之间的因果关系,通过逆转录病毒诱导的截短/过表达NOTCH1突变造血细胞的小鼠骨髓,在大约50%的动物受体中产生了T细胞肿瘤。2004年,Weng等人报告称,T-ALL细胞系对γ-分泌酶抑制剂敏感,这些细胞系随后被发现携带NOTCH1基因的PEST结构域和异二聚体化结构域的激活突变。对儿童和青少年原发性T-ALL样本进行的靶向测序揭示,在跨越HOX11、TAL1、LYL1和HOXA9分子亚型的白血病中,有56%存在异二聚体化和PEST结构域的NOTCH1突变,这强调了NOTCH激活在原发性T-ALL中的高发生率。
多项儿童(ALL-BFM 2000)和成人试验(LALA-94、GRAALL-2003)发现,NOTCH1通路的激活与良好的预后相关。在P€ol€onen等人的研究中,接受AALL0434试验治疗的患者中,有超过70%存在NOTCH1通路突变。大多数NOTCH1激活突变——包括插入/缺失(indels)、单核苷酸变异(SNVs)以及终止/移码/剪接变异——与优越的5年总生存期和无事件生存期相关;然而,内含子中的NOTCH1 SNVs和基因内缺失则与较差的预后相关。
对NOTCH1突变T-ALL的单细胞研究进一步阐明了NOTCH通路突变所引发的细胞变化。Xu等人对具有亚克隆激活NOTCH1突变的ETP-ALL患者的转录组进行了基因分型,揭示了携带NOTCH1突变的白血病原始细胞主要停滞在低风险、对治疗敏感的T细胞特异性状态。该分析分离出携带两种共存NOTCH1突变的白血病原始细胞的转录组特征,揭示了NOTCH1突变剂量与T系分化之间的直接联系。
最近的多组学研究定义了新的分子亚型和遗传驱动因素,可用于T-ALL的前期风险分层。整合和单细胞分析使得在转录组、表观遗传、DNA和细胞表面蛋白水平识别T-ALL治疗耐药性的生物学特征成为可能。鉴于RNA - seq最终在临床环境中得到应用,应在未来的T-ALL试验中探索在临床样本中识别ETP样和BMP样T-ALL的基因表达分类器的临床测试。多个研究小组的有希望的数据表明,基于遗传亚型对靶向治疗有不同的反应,或可用于选择R/R T-ALL患者的新型靶向治疗。例如,BMP样T-ALL患者来源的异种移植模型对维奈克拉和navitoclax的反应表明,基于BMP样分子分类,可以在难治性疾病中分配BCL2靶向治疗。希望在T-ALL基因组亚型的临床前模型中扩大对新型靶向治疗和免疫治疗的疗效测试,揭示合理选择的靶向治疗的临床潜力,从而将基因组发现与提高治愈率联系起来。
参考文献
Xu, J., & Teachey, D. T. (2025). Genomic Classification of T-Cell Acute Lymphoblastic Leukemia: Current Paradigms and Future Biomarkers. Journal of the National Comprehensive Cancer Network (published online ahead of print 2025). Retrieved Jun 22, 2025, from https://doi.org/10.6004/jnccn.2025.7028
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言












#肿瘤异质性# #T-ALL# #T淋巴细胞白血病#
11 举报