论文解读|Xing-dong Xiong教授团队揭示circFOXO3促进内皮细胞衰老与动脉粥样硬化新机制
9小时前 Genes and Diseases Genes and Diseases 发表于上海
该研究首次揭示了circFOXO3通过结合异质核核糖核蛋白K(hnRNPK)促进内皮细胞衰老和动脉粥样硬化形成的分子机制,为干预血管老化相关疾病提供了新的潜在靶点。
随着社会经济发展和人口老龄化加剧,心血管疾病已成为威胁公众健康的重要问题。血管衰老是心血管疾病发生的主要风险因素,其核心机制之一便是血管内皮细胞的衰老。内皮细胞衰老会导致血管舒张功能受损、炎症反应加剧,进而促进动脉粥样硬化等疾病的发展。近年来,环状RNA(circRNA)作为一类新型非编码RNA,在调控细胞衰老与疾病进程中逐渐崭露头角。
近日,来自广东医科大学的Xing-dong Xiong教授团队在本刊发表了一项题为“circFOXO3 facilitated endothelial cell senescence and atherosclerosis through binding to HnRNPK”的研究快讯。首次揭示了circFOXO3通过结合异质核核糖核蛋白K(hnRNPK)促进内皮细胞衰老和动脉粥样硬化形成的分子机制,为干预血管老化相关疾病提供了新的潜在靶点。
01 circFOXO3在衰老与动脉粥样硬化中高表达
研究人员首先检测了年轻与老年个体主动脉以及增殖与衰老状态的内皮细胞中circFOXO3的表达水平,发现其在老年组(图1A)和衰老细胞(图1B)中显著升高。更重要的是,在动脉粥样硬化小鼠的主动脉组织中,circFOXO3的表达也明显上调(图1C),尤其是在血管内膜中富集,提示其可能与内皮功能密切相关。
02 circFOXO3过表达诱导内皮细胞衰老
为了明确circFOXO3的功能,研究团队构建了过表达circFOXO3的慢病毒载体,转染人脐静脉内皮细胞(HUVECs)。结果发现,过表达circFOXO3后,细胞中SA-β-gal阳性率显著升高(图1E、F),衰老相关蛋白p21、p53表达增加(图1D),同时细胞增殖能力(图1G)和成管能力(图1H)明显下降。这些结果表明,circFOXO3确实能促进内皮细胞衰老并抑制其功能。
03 动物实验进一步验证其促动脉粥样硬化作用
为进一步确认circFOXO3在体内的作用,研究团队利用Ldlr-/-小鼠模型,通过AAV病毒特异性在血管内皮中过表达circFOXO3(图1I),并配合高脂饮食诱导动脉粥样硬化。实验结果显示,circFOXO3过表达组小鼠的主动脉内膜中衰老标志物SA-β-gal活性(图1J)和p16蛋白表达显著升高,动脉粥样斑块面积明显增大(图1K),而血脂水平在两组间并无显著差异。这一发现表明,circFOXO3促进动脉粥样硬化的机制并非通过影响脂代谢,而是直接作用于血管内皮的衰老过程,进一步强化了其在血管老化及相关疾病中的关键作用。
04 circFOXO3通过结合hnRNPK发挥功能
通过亚细胞定位分析,研究人员发现circFOXO3主要分布于细胞质中(图1L)。随后利用MS2-CP pull-down联合质谱分析,筛选出与之相互作用的蛋白——hnRNPK,并通过RIP实验进一步验证了二者的结合(图1M)。
hnRNPK是一个多功能的RNA结合蛋白,参与调控染色质重构、RNA加工和DNA损伤应答等过程。本研究显示,hnRNPK在衰老内皮细胞中表达下降(图1N),其knockdown会促进细胞衰老、抑制增殖和成管能力。更重要的是,过表达hnRNPK可显著逆转由circFOXO3过表达引起的衰老表型(图1Q)和功能抑制(图1R、S)。此外,研究人员还发现circFOXO3会导致hnRNPK蛋白水平降低,而不影响其mRNA(图1O、P),提示 circFOXO3 可能在翻译或蛋白稳定性层面调控hnRNPK。
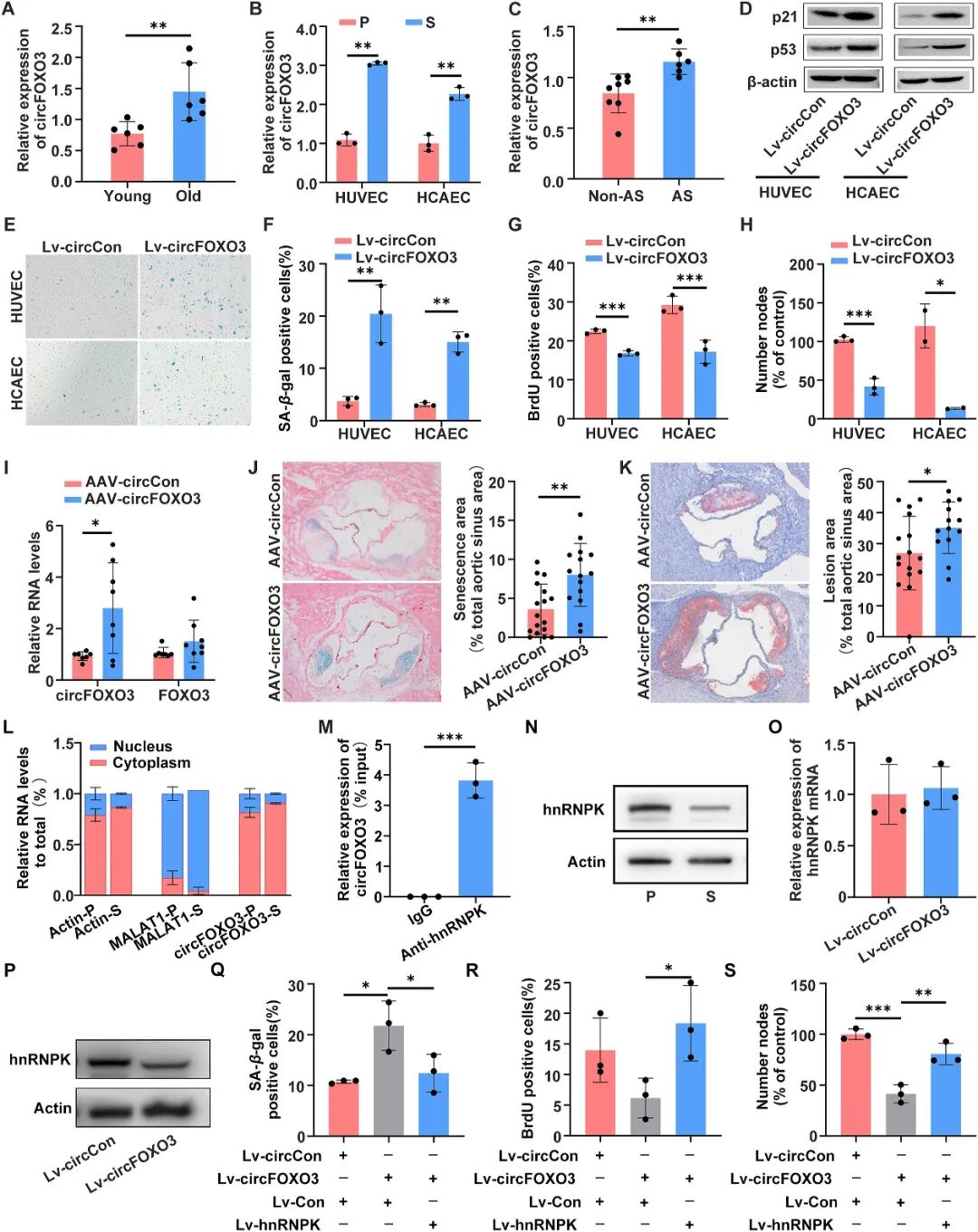
图 1. circFOXO3 通过与 hnRNPK 结合促进内皮细胞衰老和动脉粥样硬化(原文Figure 1)
总结与意义
本研究系统揭示了circFOXO3在血管内皮细胞衰老及动脉粥样硬化发生中的重要作用。 circFOXO3通过直接结合hnRNPK蛋白并降低其蛋白水平,从而促进细胞衰老、抑制增殖与血管生成能力。更为重要的是,hnRNPK的过表达可有效逆转由circFOXO3引发的衰老表型和功能障碍,表明该分子轴具有显著的干预潜力。这些发现不仅深化了对circRNA在血管老化中调控机制的理解,也为未来开发靶向circFOXO3-hnRNPK信号通路的抗衰老或抗动脉粥样硬化治疗策略提供了重要的实验依据和理论支持。
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304225000066
引用这篇文章:
Wu JY, Zhou YL, Lu SH, et al. circFOXO3 facilitated endothelial cell senescence and atherosclerosis through binding to HnRNPK. Genes Dis. 2025;12(5):101517.

本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言



















#动脉粥样硬化# #circFOXO3#
1 举报