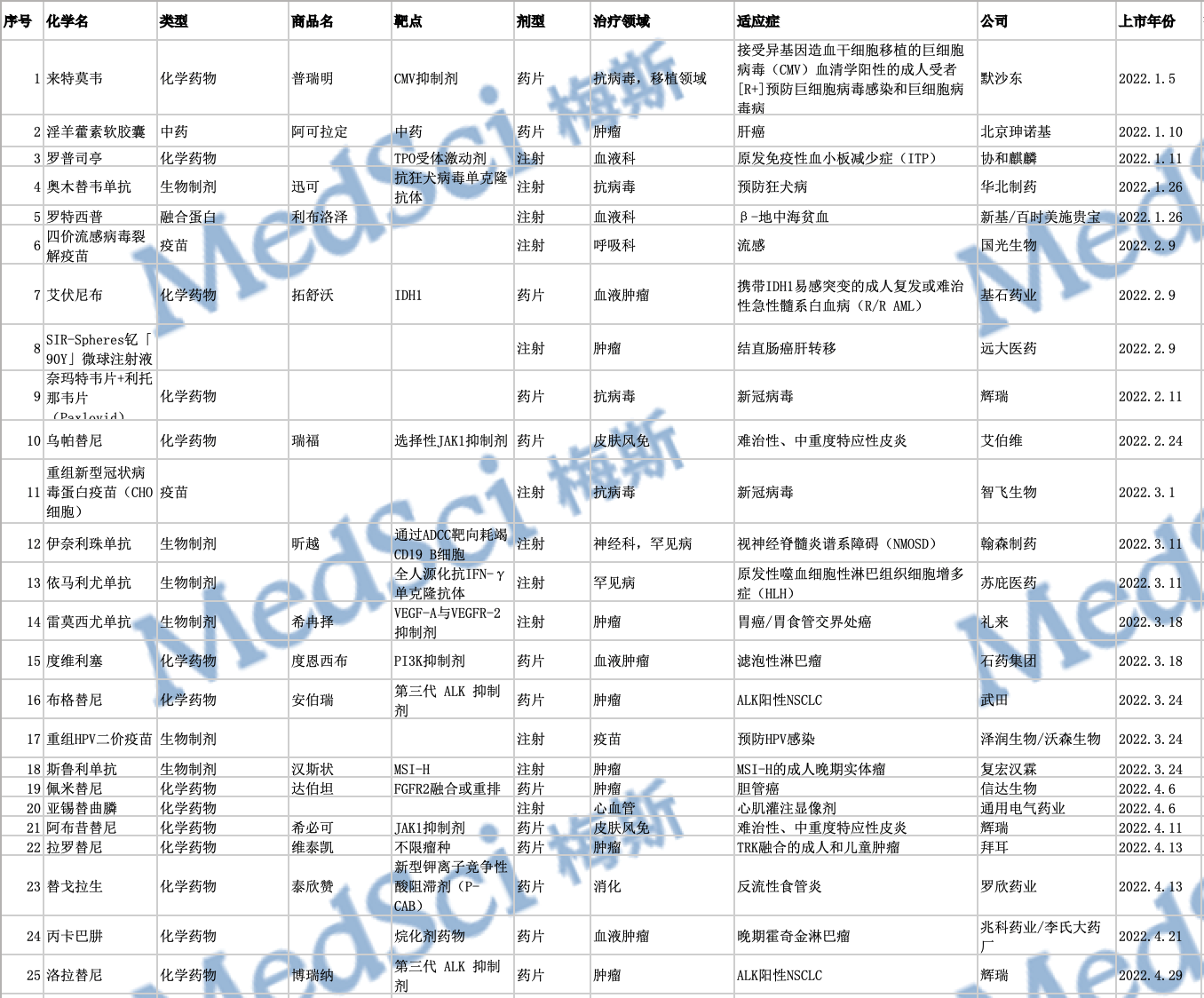
盘点:2024年NMPA批准的61款创新药物
2025-01-03 MedSci原创 MedSci原创 发表于威斯康星
2024年,按国家药品监督管理局(NMPA)批准上市的1类或1.1类新药计算,NMPA共批准了
2024年,按国家药品监督管理局(NMPA)批准上市的创新药物,NMPA共批准了61款创新药物上市。从药物类型来看,涉及31款化学药品、22款生物制品和3款中药及天然产物,在数量上再创新高。 从治疗领域来看,2024年NMPA批准的1类创新药中,抗肿瘤药依旧位居榜首,约占比一半;位居第二的是消化道和新陈代谢用药、神经系统用药、抗感染药物、中药均是获批了3款。
从审评角度来看,通过优先审评审批的药物、应急审评审批的药物、以及附条件上市的新药共有18款,占比39.13%,涉及9款化学药品、9款生物制品。其中,泰莱替尼、芦康沙妥珠单抗、西达基奥仑赛、贝莫苏拜单抗、泽沃基奥仑赛和多奈单抗获得CDE授予的突破性治疗药物。
回顾2024年度获批的1类创新药,williamhill asia 发现多款药物标志着治疗领域的“首款”新里程碑,填补了长期以来的临床治疗空白,为患者提供了更多的治疗可能性。
抗肿瘤类创新药物
芦康沙妥珠单抗:首款中国获批上市的国产TROP2 ADC,且是国内首款获得完全批准上市的国产ADC。该药用于治疗既往至少接受过2种系统治疗(其中至少1种治疗针对晚期或转移性阶段)的不可切除的局部晚期或转移性三阴性乳腺癌(TNBC),靶向人滋养细胞表面抗原2(TROP2)。与传统化疗相比,芦康沙妥珠单抗在无进展生存期和总生存期方面均显示出具有显著统计学意义和临床意义的改善。
艾帕洛利单抗+托沃瑞利单抗,复方:全球首款融合抗PD-1与抗CTLA-4双重机制的组合抗体,且是全球首创的MabPair®创新技术平台诞生的首个重大突破成果,适用于既往接受含铂化疗治疗失败的复发或转移性(R/M)宫颈癌患者的治疗。该药的获批上市,不仅是中国宫颈癌治疗领域的重大突破,也是肺癌、肝癌等多个实体瘤免疫治疗领域的一次飞跃,标志着肿瘤免疫治疗进入一个新的阶段,开启了肿瘤治疗的新篇章。
氟泽雷塞:国内NMPA批准上市的首款KRAS抑制剂药物,且是全球第三个上市的KRAS G12C抑制剂,曾获得国家药品监督管理局优先审评及两项突破性疗法资格认定,适用于至少接受过一种系统性治疗的KRAS G12C突变型晚期非小细胞肺癌(NSCLC)成人患者。该药填补了国内KRAS G12C突变靶向治疗的空白,更以其快速缓解、疗效持久、突破血脑屏障强效对抗脑内肿瘤、耐受性良好等的特点,为患者提供了显著的生存期延长和生活质量提升的可能。
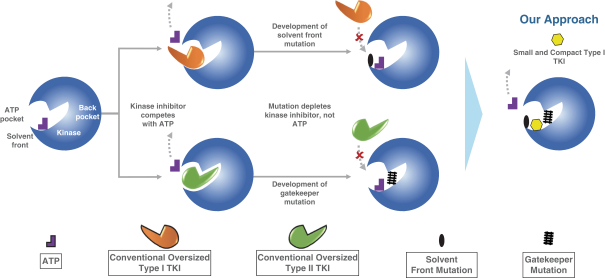
佐利替尼:全球首款专门面向伴CNS转移的晚期非小细胞肺癌开展注册临床试验并取得显著成果的药物,且是目前唯一明确采用非血脑屏障外排蛋白底物设计的EGFR酪氨酸激酶抑制剂(EGFR-TKI),可100%透过血脑屏障。该药物适用于具有表皮生长因子受体(EGFR)19号外显子缺失或外显子21(L858R)置换突变,并伴中枢神经系统(CNS)转移的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
妥拉美替尼:全球首款且唯一获批针对NRAS突变晚期黑色素瘤适应症的MEK抑制剂,也是国内自主研发的首款MEK抑制剂。该药是一种新的针对NRAS突变的ATP非竞争性MEK抑制剂,可与RAS-RAF-MEK-ERK信号通路中的MEK1/2结合,阻断下游信号通路的传导,从而抑制肿瘤的生长。与传统MEK抑制剂相比,该药最大的优势在于没有蓄积性,适用于含抗PD-1/PD-L1治疗失败的NRAS突变的晚期黑色素瘤患者。
皮肤领域创新药物
夫那奇珠单抗:首款国内自主研发的靶向IL-17A的中重度银屑病创新药,且是恒瑞在自身免疫疾病领域上市的首个创新药。该药物通过特异性结合血清中的IL-17A蛋白,阻断IL-17A与IL-17RA(IL-17A受体)的结合,抑制炎症的发生和发展,用于治疗适合接受系统治疗或光疗的中重度斑块状银屑病成人患者。
司普奇拜单抗:国内首个款治疗慢性鼻窦炎伴鼻息肉的生物制剂。该适应症药品上市许可申请于今年6月获国家药监局受理,并被纳入优先审评审批程序。这是司普奇拜单抗继今年9月批准用于治疗成人中重度特应性皮炎之后获批的第二个适应症,成为目前国内首个批准用于治疗慢性鼻窦炎伴鼻息肉的生物制剂。慢性鼻窦炎伴鼻息肉是一种以2型炎症为主的慢性炎症性疾病,在中国约有3800万患者,其中,约50%的患者经过规范化药物和手术治疗后仍无法取得满意疗效,症状持续或息肉复发。
赛立奇单抗:国内首款全人源IL-17A靶点药物,打破了抗IL-17A单抗外资药企垄断的局面,填补了国产银屑病生物制剂领域空白。该药是一款重组全人源抗IL-17A单克隆抗体,可通过抗体特异性结合血清中的IL-17A细胞因子,阻断IL-17A与IL-17RA的结合,抑制炎症的发生和发展,从而对IL-17A过表达的斑块状银屑病、中轴型脊柱关节炎等自身免疫性疾病达到治疗效果。
神经系统创新药物
仑卡奈单抗:国内首款用于治疗早期阿尔茨海默病的生物制剂,也是20年来全球首款获生物标志物和临床量表双重验证的抗Aβ疾病修饰药物。该药可以选择性结合可溶性Aβ聚集体(原纤维*),以及AD中Aβ斑块的主要成分——不溶性Aβ聚集体(纤维),从而减少大脑中的Aβ原纤维和Aβ斑块,用于治疗由阿尔茨海默病引起的轻度认知障碍和阿尔茨海默病轻度痴呆。2023年4月发布于《神经病学和治疗》的模拟模型评估数据则显示,联合使用仑卡奈单抗和胆碱酯酶抑制剂治疗,能使AD患者的病情进展平均延迟2到3年。
多奈单抗:首款有证据支持在清除淀粉样蛋白斑块后可停药的靶向疗法,能够识别并结合到大脑中沉积的β淀粉样蛋白(Aβ)斑块上的N-末端焦谷氨酸修饰表位。该药的显著特点是它并非需要终身服药,而是根据患者的治疗反应和淀粉样蛋白斑块清除情况来决定是否可以停止治疗。一旦通过正电子发射断层扫描(PET)确认患者的淀粉样蛋白水平已经降至视觉上为阴性的标准,则可以完成治疗,并在后续的研究期间切换到安慰剂或其它维持疗法。
内分泌类创新药物
依柯胰岛素:全球首款胰岛素周制剂,是中国在糖尿病药物开发领域首次实现与欧盟和美国同步开展临床试验,同步递交上市申请,NMPA首次早于美国FDA批准了这款糖尿病治疗药物。该药适用于治疗成人2型糖尿病。经过创新的分子设计和结构修饰,依柯胰岛素的作用时间显著延长,兼顾疗效与安全性,一周仅需注射一次,有效改善胰岛素治疗依从性,开启胰岛素治疗周制剂时代。
考格列汀:全球首款双周超长效二肽基肽酶-4抑制剂(DPP-4i),通过抑制 DPP-4 活性,减少 DPP-4水解肠促胰岛激素,从而增加活性形式的胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)的血浆浓度,以葡萄糖依赖的方式增加胰岛素释放并降低胰高血糖素水平,降低血糖。用于改善成人2型糖尿病(T2DM)患者的血糖控制。这标志着我国首个双周制剂降糖药物成功面世,同时也意味着糖尿病治疗领域开始从日制剂、周制剂迈向双周制剂的新时代。这一创新药物的诞生,将为糖尿病患者带来前所未有的治疗体验。
血液肿瘤和血液病创新药物
西达基奥仑赛:国内首款同时拥有三大适应症的CAR-T产品,用于治疗复发或难治性多发性骨髓瘤成人患者,既往接受过至少三线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。西达基奥仑赛于2022年2月获得美国FDA批准上市,作为复发或难治性多发性骨髓瘤成人患者的末线治疗。今年4月,该药在美扩展二线治疗多发性骨髓瘤新适应症。其原理与目前的PD-1/L1不同,它是直接利用患者体内的T细胞,将其在体外进行改造,大量复制后再会输到患者体内,以达到杀灭癌细胞的目的。
戈利昔替尼:全球首款且是目前唯一针对PTCL(外周T细胞淋巴瘤)的高选择性JAK1抑制剂。PTCL是一种具有侵袭性且预后不良的非霍奇金淋巴瘤,目前尚无统一的标准治疗方案,特别是在复发或难治性PTCL(R/R PTCL)的治疗上,存在巨大的医疗需求。该药以其新型口服、高选择性JAK1抑制剂的特性,在临床试验中显示出了显著的疗效和良好的安全性,因此被推荐作为单药治疗R/R PTCL的方案,已在美国开展外周T细胞淋巴瘤临床Ⅱ期试验。
其它
泰吉利定:首款获批适应症是用于治疗腹部手术后中重度疼痛,且是中国首款自主研发1类阿片类镇痛新药。具有全新的化学实体和药理作用机制,是G蛋白偏向性μ阿片受体的高活性和高选择性激动剂,在激活G蛋白通路的同时减少对胃肠道抑制和呼吸抑制相关的β-arrestin通路调节作用。相较于传统μ阿片受体激动剂,发挥有效镇痛作用的同时可减少胃肠功能障碍、呼吸抑制等不良反应。
伊普可泮:全球同类首创特异性补体B因子口服抑制剂,作用于免疫系统的补体旁路途径中的近端通路,可全面控制血管内溶血和血管外溶血,弥补抗C5抗体治疗的缺陷,开创了PNH靶向治疗的全新时代。该药适用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。在美国食品药品监督管理局(FDA)获批仅4个月后,该药在中国成功获批。
克瑞加巴林:国内首款获批DPNP治疗适应症的1类新药,拥有独立自主知识产权,也是全球首款无需滴定的第三代中枢神经系统钙离子通道调节剂,具有无需滴定、快速起效、耐受良好、持续有效的特点。它是第三代中枢神经系统钙离子通道调节剂,是一种口服γ-氨基丁酸(GABA)类似物,可通过与共价不可逆修饰中枢神经系统电压敏感型钙离子通道α2δ受体结合,减少中枢神经系统电压依赖性钙通道的钙离子内流,从而减少谷氨酸盐、去甲肾上腺素(Noradrenaline,NE)和P物质等兴奋性神经递质的释放,具有镇痛、抗癫痫和抗焦虑的活性。
九味止咳:全球首款按照化药标准研发的1.1类中成药。该药由由矮地茶、枇杷叶、麻黄、苦杏仁、薄荷、陈皮、竹茹、鱼腥草和炙甘草九味中药材精炼而成,宣肺止咳。该药适用于急性气管—支气管炎中医辨证属风热证的咳嗽,伴见咳痰、咽干,舌红苔薄黄、脉浮数或浮滑,是治疗急性气管—支气管炎的一种新的选择方案。
泽美洛韦单抗+玛佐瑞韦单抗,复方:该药是一款抗狂犬病病毒单克隆抗体组合制剂——单抗鸡尾酒疗法产品,也是国内首款抗狂犬病鸡尾酒抗体,主要用于成人狂犬病病毒暴露者的被动免疫。由两株靶向狂犬病毒糖蛋白不同中和位点的人源化单克隆免疫球蛋白IgG1κ抗体——泽美洛韦单抗(Zamerovimab)和玛佐瑞韦单抗( Mazorelvimab)按照质量比1:1混合制成。它能通过对狂犬病毒多个糖蛋白位点的特异性结合,中和狂犬病毒,从而消除病毒对神经细胞的感染能力。
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言












#NMPA#
14