Chinese Medicine:中草药与抗癌药物的相互作用,药效与药代动力学机制及风险预测
2025-07-10 吾乃喵大人 MedSci原创 发表于上海
本综述整合了HDIs领域的最新研究进展,首次系统性从PD与PK两方面解析了中草药与抗癌药物相互作用的分子机制。
研究亮点
- 首次系统性解析中草药与抗癌药物的药效动力学(PD)及药代动力学(PK)相互作用机制,揭示两者协同、拮抗与解毒等多维度影响途径。
- 汇总并评估多种风险预测方法,包括PBPK建模、网络药理学及人工智能辅助数据库建设,为临床安全合理联合用药提供新思路。
- 提出基于机制研究的临床应用策略,助力精准肿瘤治疗中草药与化疗药物的科学整合与风险管控。
中草药在世界范围内作为辅助治疗手段的使用率持续攀升。据统计,美国健康人群中草药使用率从1997年的12%增长至2015年的三分之一;在非洲则有高达80%的人口接受过草药治疗。尤其在中国,传统中医药已被纳入疾病诊疗威廉亚洲博彩公司 和医保体系,应用普遍且深远。然而,草药往往与西药联合使用,尤其是伴随化疗的癌症治疗中,导致潜在的药物相互作用,影响治疗效果甚至安全性。
近年来,随着中草药在全球特别是肿瘤患者中的广泛应用,草药与抗癌药物(Anticancer Drugs,简称ACDs)联合用药导致的草药-药物相互作用(Herb-Drug Interaction, HDI)问题愈发突出。本文系统阐述了HDIs的药效动力学和药代动力学机制,并重点总结了HDIs的风险预测方法,助力临床安全合理地将中草药纳入肿瘤综合治疗中。

一、药效动力学(PD)介导的草药-抗癌药物相互作用
HDIs在PD层面主要表现为:拮抗、协同及解毒作用三类。
1. 拮抗作用
拮抗作用是指草药与抗癌药物合用时,整体药效低于各自单独用药效应的总和,可能降低抗癌药物的疗效或毒性。
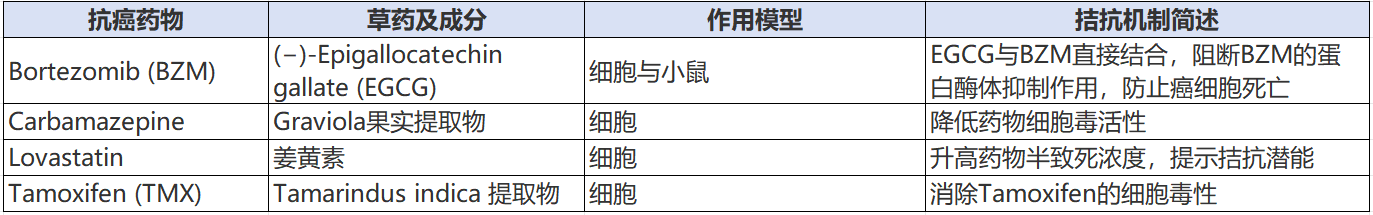
拮抗常见于草药成分与ACDs直接结合或靶向相反机制,导致疗效抵消。
2. 协同作用及多靶点效应
肿瘤多路径调控使单靶点药物易失效,草药多组分特性具备针对多靶点发挥协同效应的潜能。联合中草药可增强凋亡、抑制肿瘤转移和耐药机制。
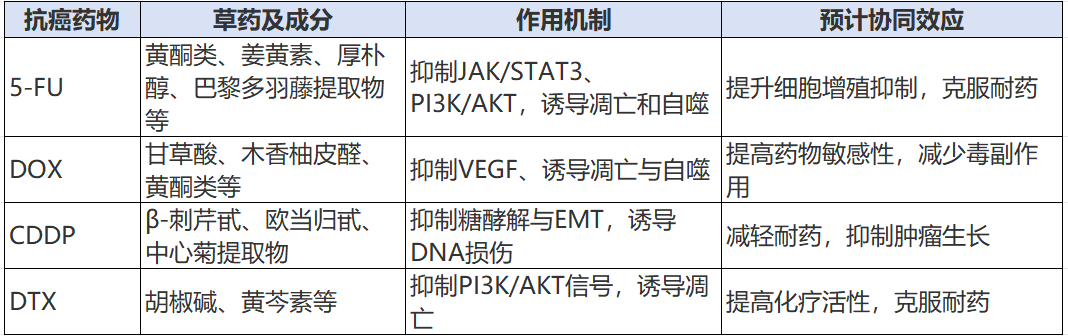
机制解析
- 抑制抗凋亡系统:通过调控Bcl-2、p53、PI3K/AKT/mTOR通路,恢复肿瘤细胞凋亡敏感性。
- 诱导非凋亡细胞死亡:促进细胞自噬、铁死亡或坏死,克服传统耐药障碍。
- 抑制上皮-间质转化(EMT):阻止肿瘤侵袭转移,促进化疗敏感性提升。
- 抑制肿瘤血管生成:减轻肿瘤缺氧耐药,提高化疗效能。
3. 解毒作用
抗癌药物常伴随严重器官毒性,如肾、肝、心脏及神经系统损伤。中草药可通过抗氧化、抗炎、调节信号通路缓解这些不良反应。
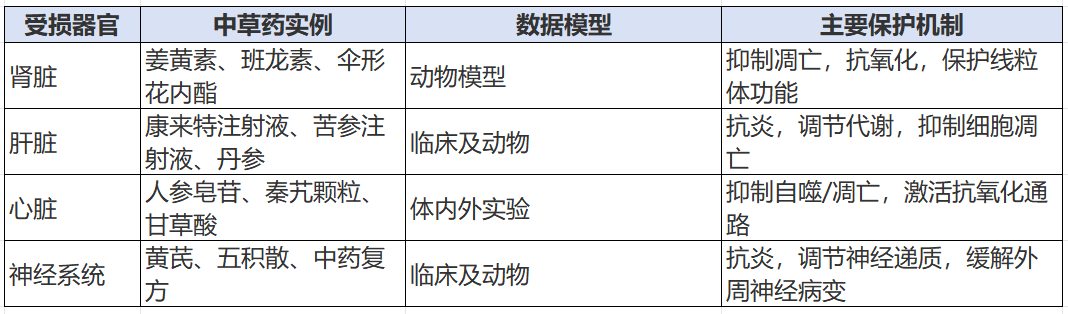
二、药代动力学(PK)介导的草药-抗癌药物相互作用
抗癌药物的疗效及毒性与其体内血浆及肿瘤浓度密切相关,草药通过影响药物代谢酶(DME)和转运蛋白(DT)发挥PK层面的相互作用。
1. 药物代谢酶介导的相互作用
肝脏CYP酶尤为关键,特别是CYP3A4,在约50%抗癌药物代谢中发挥重要作用。草药可能诱导(如圣约翰草)或抑制(如人参)CYP3A4,影响ACDs血浓度,导致疗效减弱或毒性增强。
- 诱导例:圣约翰草主要活性成分hyperforin通过激活pregnane X受体显著诱导CYP3A4,降低伊马替尼、伊立替康、多西他赛的血浆浓度及疗效。
- 抑制例:人参抑制CYP3A4代谢,曾导致伊马替尼代谢减慢并诱发肝毒性。
UGT酶介导的Ⅱ相代谢亦重要,对伊立替康活性代谢物SN-38的清除至关重要。草药抑制UGT1A1/UGT1A9可引发剧烈毒性,诱发胃肠道副反应。
2. 药物转运蛋白介导的相互作用
转运蛋白根据方向分为摄取与外排两类,均影响药物的分布和排泄。

同时,转运蛋白基因多态性显著影响HDIs的个体差异,尚需更多研究支持。
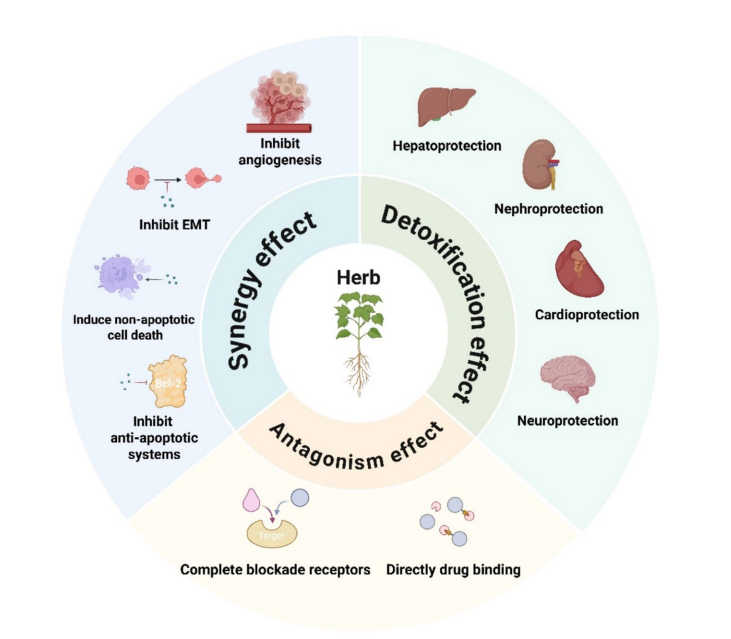
图1:草药与抗癌药物药效动力学介导的相互作用机制示意图
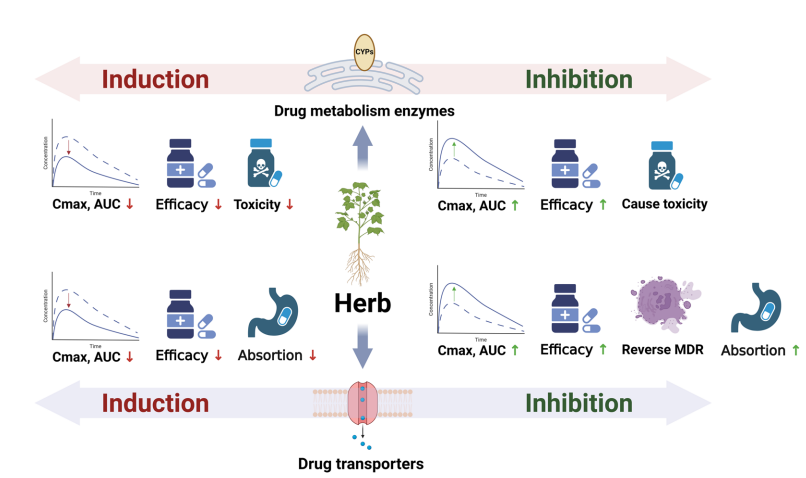
图2:草药与抗癌药物药代动力学介导的相互作用机制示意图
研究意义与展望
本综述整合了HDIs领域的最新研究进展,首次系统性从PD与PK两方面解析了中草药与抗癌药物相互作用的分子机制。此外,该研究阐释了多种风险预测方法,如PBPK模型的应用、网络药理学对多靶点作用的揭示,以及人工智能辅助的数据库建设,强调了传统药物相互作用研究与现代计算技术相结合的重要性,为临床判断草药与化疗药物安全合理联合提供了新的技术支持。
尽管如此,目前研究仍存在草药化学成分复杂、成分间相互影响及剂型与来源标准化缺失等限制,亟待多学科协作推动草药活性成分标准化鉴定及临床前后药代动力学研究,完善数据库及AI模型,提升HDIs预测的准确性。
未来结合草药活性成分深入挖掘HDIs的联合用药模式与剂量调整,辅以动态监测生物标志物,将有助于实现肿瘤患者的安全、个性化治疗,促进中草药与现代抗癌治疗的融合发展。
原始出处
Duan X, Fan X, Jiang H, Li J, Shen X, Xu Z, Zhou Z, Xu J*, Chen C*, Jin H*. Herb-drug interactions in oncology: pharmacodynamic/pharmacokinetic mechanisms and risk prediction. Chinese Medicine. 2025;20:107. https://doi.org/10.1186/s13020-025-01156-4
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言













#药代动力学# #药效动力学#
5 举报