JHO:芦康沙妥珠单抗用于标准治疗难治性不可切除局部晚期或转移性实体瘤患者的1/2期研究结果
2025-06-30 吾乃喵大人 MedSci原创 发表于上海
本研究首次系统评估了Sac-TMT在不可切除晚期实体瘤中的安全性及初步疗效,特别是在转移性TNBC及HR+/HER2-乳腺癌中的应用。
亮点总结
- 芦康沙妥珠单抗(Sac-TMT)作为抗TROP2抗体药物偶联物,在不可切除局部晚期及转移性三阴性乳腺癌(TNBC)及HR+/HER2-乳腺癌患者中展现出良好的安全性及诱人的抗肿瘤活性。
- 经过剂量递增,确定最大耐受剂量为5.5 mg/kg,推荐扩展剂量为4 mg/kg和5 mg/kg。
- 在Ⅱ期扩展队列中,TNBC患者的客观缓解率(ORR)达到34.8%至38.9%,HR+/HER2-乳腺癌患者ORR达到31.7%,显示其潜在的临床应用前景。
近日,发表于2025年《Journal of Hematology & Oncology》的一项由Ouyang等人发起的多中心I/II期临床研究(注册号:NCT04152499)公布了抗TROP2抗体药物偶联物Sac-TMT在不可切除局部晚期或转移性实体瘤患者中的安全性和疗效结果。该研究由中国四川科伦生物医药有限公司与美国默克公司联合支持,涵盖了多种类型晚期实体瘤患者,重点考察了三阴性乳腺癌及HR+/HER2-乳腺癌的治疗反应。研究验证了Sac-TMT较为良好的耐受性及显著的抗肿瘤活性,支持其在未来更大规模试验中的进一步应用。

免疫治疗已成为多种实体瘤,尤其是转移性三阴性乳腺癌的标准治疗组成部分,但仍存在显著的耐药和疾病进展问题,迫切需要新型治疗策略。TROP2是一种高表达于多种肿瘤类型表面的跨膜糖蛋白,与肿瘤增殖、迁移及不良预后密切相关,成为抗肿瘤靶点的研究热点。已有的抗TROP2 ADC,如Sacituzumab govitecan,已获批用于晚期TNBC及HR+/HER2-乳腺癌,显示出良好的疗效。Sac-TMT是新型抗TROP2 ADC,采用相同的抗体部分,搭配不同的连接子和派生自贝洛特康的拓扑异构酶I抑制剂KL610023,优化了ADC的稳定性和药理特性,有望减少毒副作用并提升治疗效果。
研究方法
本项开放标签、国际多中心临床试验包括Ⅰ期剂量探索和Ⅱ期剂量扩展两部分。
- Ⅰ期招募不可切除局部晚期或转移性实体瘤(包括但不限于乳腺癌、肺癌、胃癌等)患者,采用2 mg/kg至12 mg/kg的Sac-TMT静脉给药,每两周一次,旨在确定最大耐受剂量(MTD)及Ⅱ期推荐扩展剂量(RDE)。
- Ⅱ期专注于转移性TNBC和HR+/HER2-乳腺癌队列,根据Ⅰ期确定的RDE进行治疗,主要终点为客观缓解率(ORR),次要终点包括无进展生存期(PFS)、总体生存期(OS)及安全性分析。
研究结果
Ⅰ期剂量递增
共计30名患者接受Sac-TMT治疗,剂量组分布如下:2 mg/kg (4人),4 mg/kg (7人),5 mg/kg (7人),5.5 mg/kg (5人),6 mg/kg (7人)。
- 剂量限制性毒性(DLT)包括3级口腔炎、3级皮疹及3级荨麻疹,主要分布在4 mg/kg及以上剂量组。
- 6 mg/kg剂量组中,29%的患者出现DLT,最大耐受剂量确定为5.5 mg/kg,基于安全和毒性数据,Ⅱ期推荐剂量为4 mg/kg及5 mg/kg。
- 常见治疗相关不良事件(TRAEs)包括恶心(63%)、脱发(57%)、贫血(50%),多数为轻/中度,治疗相关3/4级不良事件占57%,无人出现治疗相关死亡。
Ⅰ期关键药代动力学参数
Sac-TMT ADC及总抗体浓度随剂量升高呈线性增加,KL610023(payload)浓度也随剂量增加。
抗药物抗体(ADA)出现率在低剂量组较低,仅零星发生。
Ⅱ期剂量扩展(TNBC及HR+/HER2-乳腺癌)
| 组别 | 患者数 | ORR % (95% CI) | 主要客观缓解 | 中位缓解持续时间(月) | 中位PFS(月) | 中位OS(月) |
|---|---|---|---|---|---|---|
| TNBC 4 mg/kg | 23 | 34.8 (16.4–57.3) | PR 34.8%,CR 0 | 11.5 (5.4–22.1+) | 5.8 | 12.1 |
| TNBC 5 mg/kg | 36 | 38.9 (23.1–56.5) | PR 33.3%,CR 5.6% | 11.5 (3.7–19.3+) | 5.5 | 17.1 |
| HR+/HER2- 5 mg/kg | 41 | 31.7 (18.1–48.1) | PR 31.7%,CR 0 | 9.5 (4.2–17.0+) | 8.0 | 13.9 |
(表1:Ⅱ期队列肿瘤反应总结)
患者治疗期间多数报告至少一例TRAE,TNBC及HR+/HER2-队列中,最常见的3/4级TRAEs为贫血、白细胞减少和中性粒细胞减少。治疗中断和剂量调整均较少,极少因不良事件完全终止治疗。
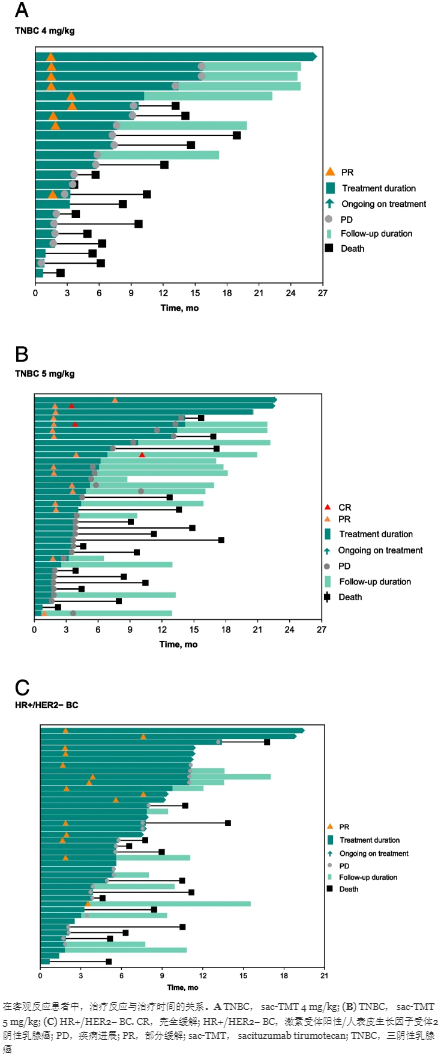
研究中部分患者治疗时间与反应示意图(TNBC 4 mg/kg、5 mg/kg及HR+/HER2- 5 mg/kg)
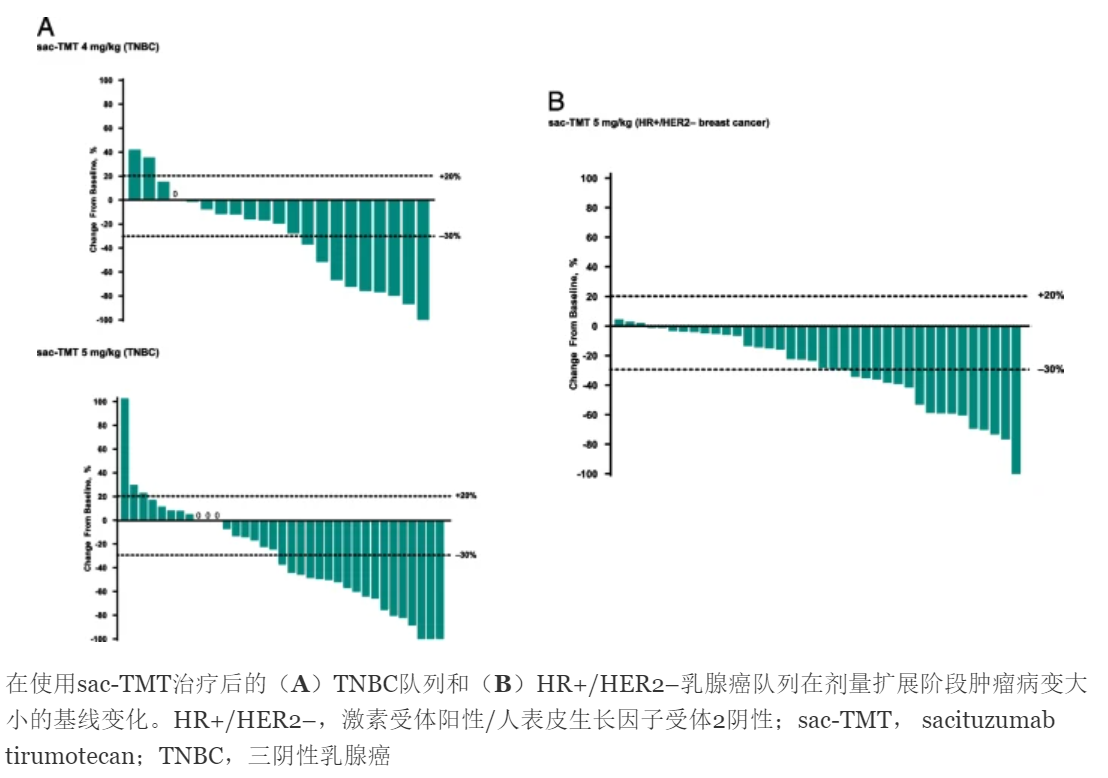
肿瘤病灶大小变化瀑布图,显示多数患者有肿瘤缩小趋势。
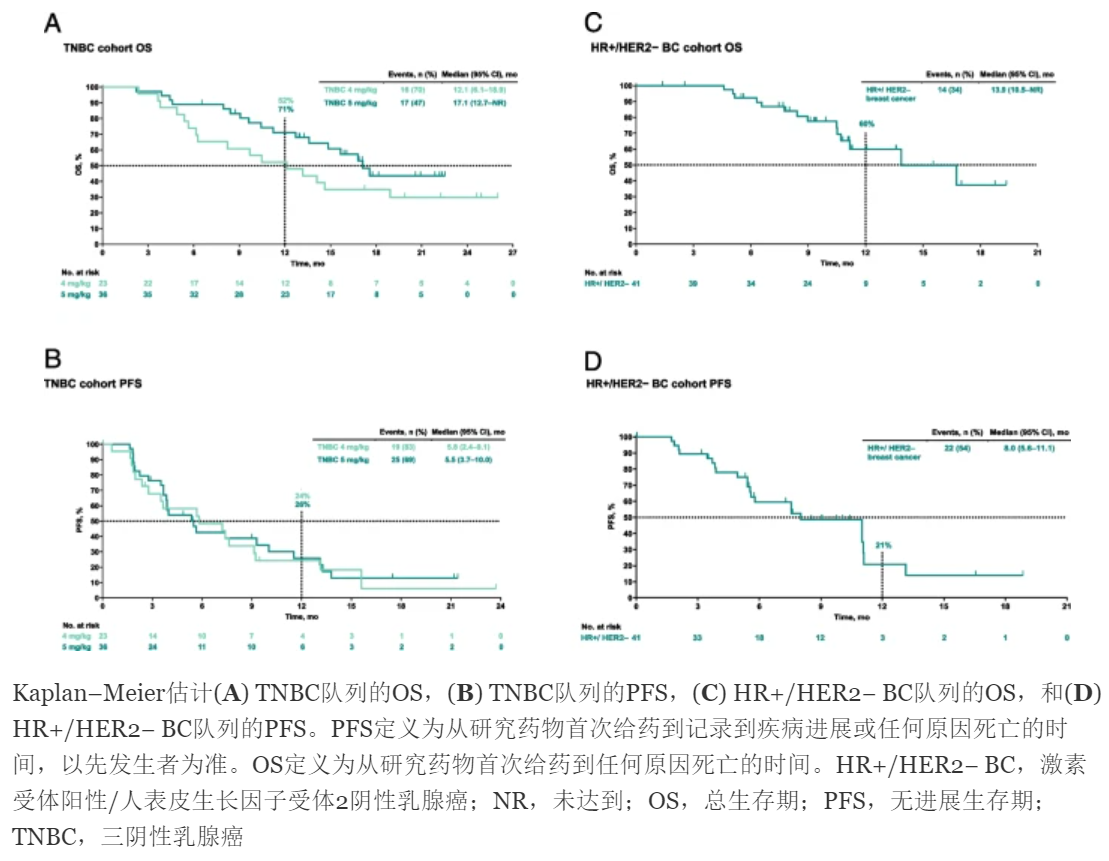
存曲线Kaplan-Meier图,显示3组的PFS及OS估计情况。
本研究首次系统评估了Sac-TMT在不可切除晚期实体瘤中的安全性及初步疗效,特别是在转移性TNBC及HR+/HER2-乳腺癌中的应用。Sac-TMT利用稳定的连接子确保payload高效释放,减少非特异性毒副作用,Ⅰ期确认最大耐受剂量为5.5 mg/kg,常见毒性主要为口腔炎及皮肤反应,均可被有效管理。
2个推荐剂量(4 mg/kg与5 mg/kg)在Ⅱ期均展现出较高的ORR及较长的缓解持续时间,与目前获批的Sacituzumab govitecan疗效相仿,但显示出潜在更优的毒性谱,尤其中性粒细胞减少等血液毒性相对较低,提示新型payload的优势。
此外,HR+/HER2-乳腺癌患者组同样表现出可观的治疗反应,提供了该ADC在非三阴乳腺癌中的进一步开发依据。鉴于该项研究的受试患者普遍为预处理、高度耐药的群体,Sac-TMT的活性尤为值得关注。
当前研究局限于单臂设计及样本量有限,未来多中心、随机对照的Ⅲ期研究将更准确评估其疗效及安全优势,如OptiTROP-Breast01研究中数据显示Sac-TMT单药治疗TNBC有显著的疗效提升,预示其潜在临床价值。
williamhill asia 小编点评
Sac-TMT作为一款结构优化的新型抗TROP2 ADC,不仅凭借创新的payload带来了更优药代学特性,且其良好耐受性和临床活性为晚期难治乳腺癌患者提供了新的选择。尤其是TNBC患者面对有限的治疗手段,该药的出现无疑为临床带来曙光。未来结合免疫疗法的联合用药研究,以及生物标志物筛选与机制探究,将推动该领域个体化治疗方案的进步,为患者带来更精准和有效的治疗管理。
原文出处
Ouyang Q, Rodon J, Liang Y, et al. Results of a phase 1/2 study of 芦康沙妥珠单抗 in patients with unresectable locally advanced or metastatic solid tumors refractory to standard therapies. J Hematol Oncol. 2025;18:61. https://doi.org/10.1186/s13045-025-01705-2
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#乳腺癌# #芦康沙妥珠单抗#
23 举报