这种癌症为何专找年轻女性?Nature(48.5)重磅:关键机制被破解,这一激素通路是关键
2025-07-03 williamhill asia 学术 MedSci原创 发表于上海
Nature研究发现,E-cadherin缺失通过β-catenin激活ERα与GRPR,形成正反馈环路,驱动绝经前女性恶性黑色素瘤等癌症易感性,靶向ERα/GRPR可阻断该恶性循环。
整体来看,男性一生中的患癌风险高于女性,但在特定年龄段、特定癌种里,女性却反超——恶性黑色素瘤就是典型例子。绝经前的高雌激素状态似乎赋予年轻女性更高的易感性,而雌激素在肿瘤发生、发展与转移中的作用正日渐受到关注。最新发表于Nature的研究把目光锁定在这一“女多男少”现象上,聚焦黏附分子E‑cadherin(由CDH1编码)在雌激素应答中的地位,并首次串联起E‑cadherin缺失、GRPR上调与癌症转移的完整链条。

DOI:10.1038/s41586-025-09111-x
核心发现:E‑cadherin缺失与GRPR“合谋”
全球流行病学数据提示,24种常见癌症中,有13种在绝经前女性的发病率显著高于同龄男性。其中恶性黑色素瘤最突出。多基因分析后仅CDH1表达在年轻女性体内显著低于男性与年长女性,暗示其与雌激素驱动的癌症易感性相关。
在小鼠黑色素瘤模型里,单纯敲除Cdh1不能诱发肿瘤;然而一旦与NRAS(Q61K) 突变并存,雌性小鼠肺转移率飙升至63%,远超对照组的16%。RNA‑seq结果显示,GRPR(胃泌素释放肽受体)成为缺失E‑cadherin后显著上调的“首要嫌疑人”,这一发现随后被H3K27ac ChIP‑seq的表观遗传证据坐实。
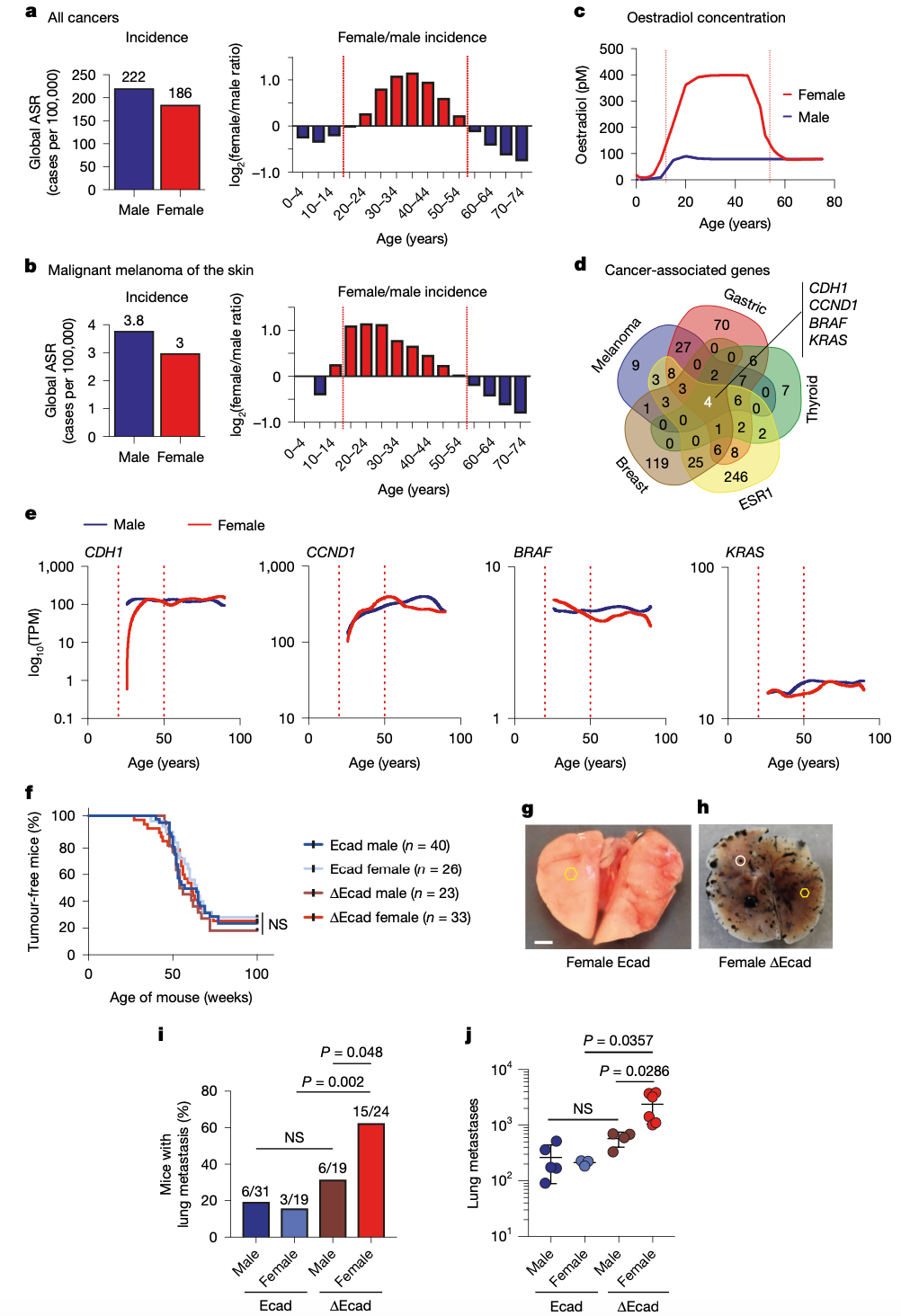
E-cadherin缺失驱动性别特异性黑色素瘤转移
机制链路:GRPR 点燃“多米诺”
进一步实验表明,仅靠Grpr表达就足以让黑色素瘤细胞在小鼠肺部落地生根。体外功能测试显示,GRPR阳性细胞克隆形成力更强,更耐悬浮凋亡(anoikis),侵袭力也随之增加。信号追踪发现,GRPR通过Gαq/11‑PKC轴激活YAP1,后者直接关联肿瘤侵袭与转移能力。
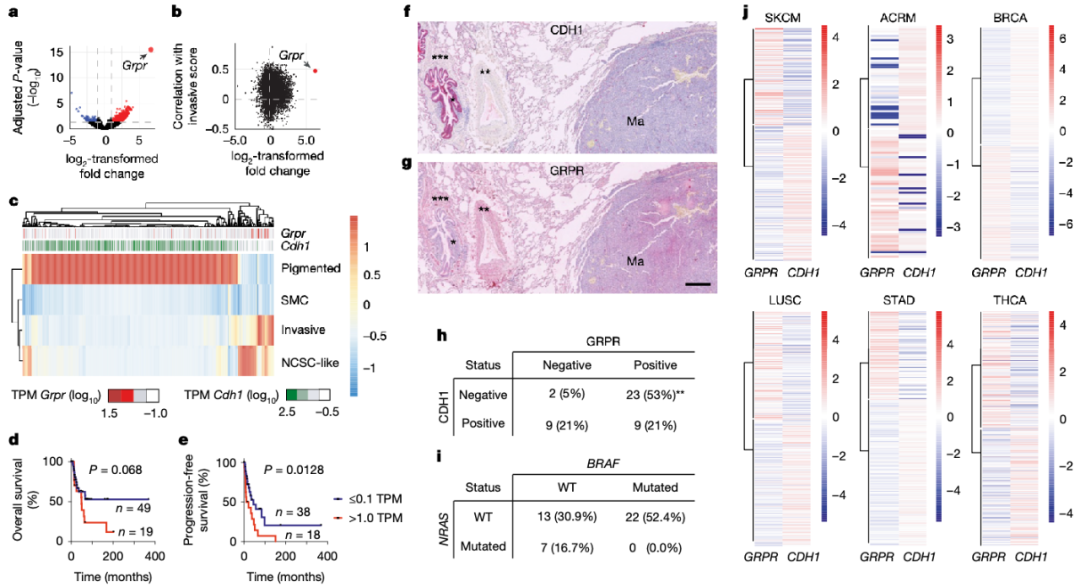
E-cadherin缺失特异性上调雌性GRPR表达
雌激素的“双刃剑”与正反馈回路
E‑cadherin缺失使β‑catenin信号活跃,进而同步上调ESR1(雌激素受体‑α)与Grpr。在黑色素瘤和乳腺癌模型中,雌激素受体的激活不仅提升GRPR表达,GRPR反过来又抑制Cdh1,形成放大式正反馈:E‑cadherin↓ → β‑catenin↑ → ERα↑ / GRPR↑ → E‑cadherin 更低 → …
该闭环在雌性背景下尤为明显,加速肿瘤转移。
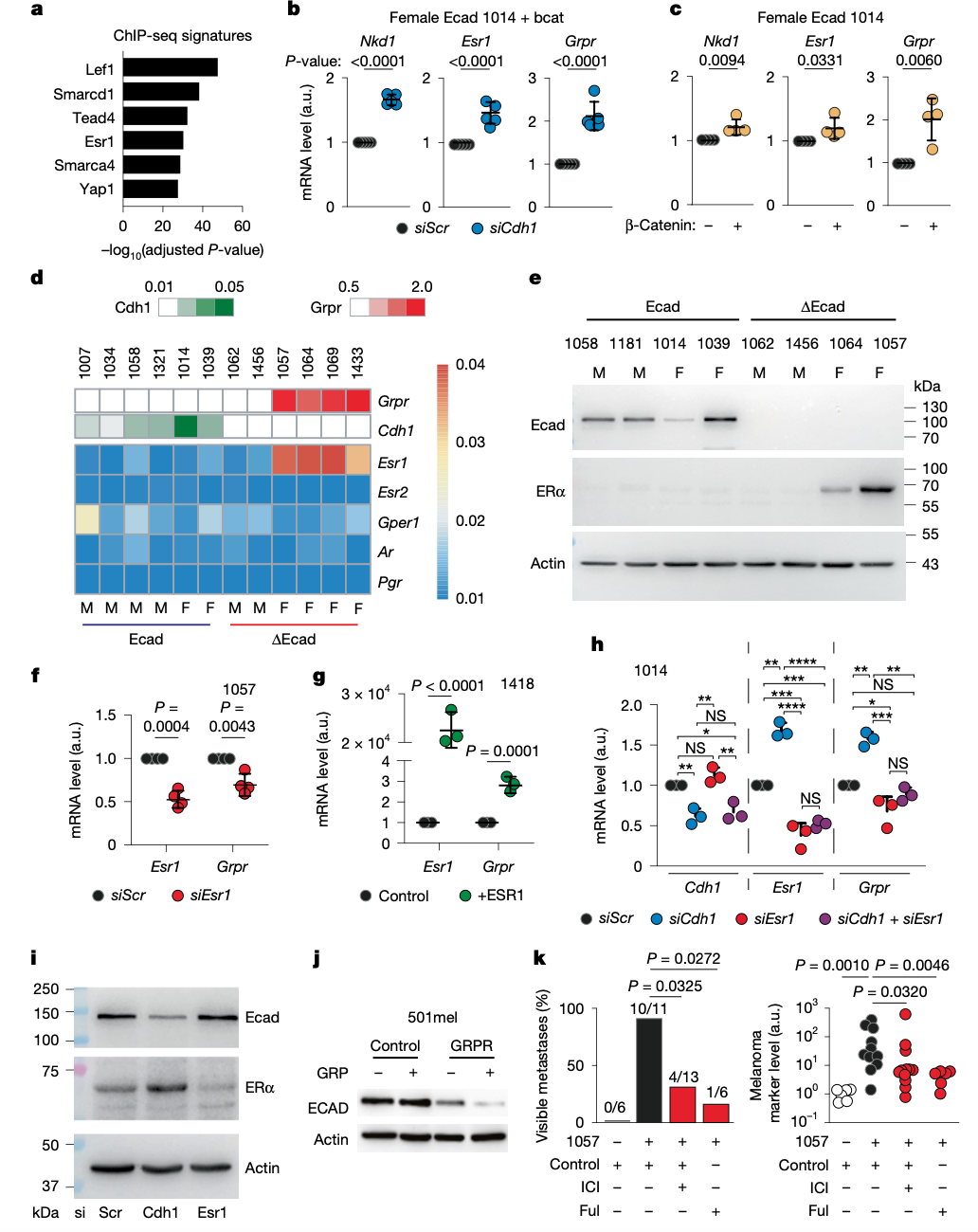
CDH1–β-catenin–ESR1–GRPR正反馈环路
临床启示:靶向 ERα/GRPR,阻断恶性循环
在黑色素瘤模型中,GRPR 拮抗剂RC‑3095显著减少肺部转移灶;雌激素受体拮抗剂Fulvestrant同样抑制体内外侵袭。乳腺癌样本分析亦发现GRPR与CDH1呈负相关,提示同一路径可能贯穿多种雌激素依赖性肿瘤。换言之,ERα‑GRPR‑E‑cadherin这一轴向,或为年轻女性易感癌症的潜在治疗突破口。
该研究提醒williamhill asia ——性别并非简单背景信息,而是影响基因、激素与微环境交互的关键维度。未来工作需要:
1.在更多癌种和人群中验证ERα‑GRPR轴的普适性;
2.探索阻断该轴的联合方案(如ERα拮抗+GRPR拮抗);
3.将激素水平、CDH1状态等指标纳入分层管理,提高年轻女性患者的诊疗精准度。
参考文献:
Raymond, J.H., Aktary, Z., Pouteaux, M. et al. Targeting GRPR for sex hormone-dependent cancer after loss of E-cadherin. Nature (2025). https://doi.org/10.1038/s41586-025-09111-x
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















#雌激素受体# #E-cadherin#
15 举报