Blood:VEN-DEC 诱导方案,年轻 AML 患者的有效且安全选择
2025-03-09 daikun MedSci原创 发表于陕西省
本研究旨在评估VEN联合地西他滨(VEN-DEC)与强化化疗在新诊断的年轻AML患者中的疗效和安全性,结果显示VEN-DEC在年轻AML患者中表现出与IA-12相当的反应率,并且在安全性方面具有优势。
急性髓系白血病(Acute Myeloid Leukemia, AML)是一种常见的成人急性白血病,其五年总生存率约为31.7%。传统上,对于适合接受强化化疗的年轻AML患者,采用阿糖胞苷和蒽环类药物的“7+3”方案作为标准诱导治疗方案。然而,这种方案存在显著的毒性,包括骨髓抑制、中性粒细胞减少性发热、感染和出血等,早期死亡率高达10-29%。因此,寻找更有效且毒副作用较小的诱导治疗方案具有重要意义。维奈克拉 (VEN) 是一种选择性 B 细胞淋巴瘤 2 (BCL2) 抑制剂,目前与去甲基化药物 (HMAs) 结合用于治疗老年 AML 患者,或无法进行强化化疗的患者。VEN-HMAs 联合方案彻底改变了 AML 的治疗格局。在 VIALE-A 研究中,VEN 加阿扎胞苷的复合完全缓解 (CRc) 率为 66.4%,早期死亡率低至 6%,并延长了具有中等和不利遗传风险老年患者的总生存期。此外,VEN 与地西他滨 (VEN-DEC) 的联合方案在一项涉及具有不利风险的初诊 AML 患者的 2 期试验中显示出与 VEN-阿扎胞苷相当的有效性,并且感染率有所降低,VEN-HMAs已成为老年或不耐受强化化疗AML患者的标准一线治疗。然而,在未经治疗的年轻AML患者中,关于VEN-HMAs组合的前瞻性数据仍然缺乏。本研究旨在评估VEN联合地西他滨(VEN-DEC)与强化化疗(Intensive Chemotherapy, IC)在新诊断的年轻AML患者中的疗效和安全性。
方法
本研究是一项多中心、开放标签、随机、IIb期试验,旨在评估VEN-DEC与IC在新诊断的年轻AML患者中的非劣效性。研究在中国三个中心进行,纳入了年龄在18至59岁之间、符合强化化疗条件的患者。患者被随机分配到VEN-DEC组或IC组(IA-12,即伊达比星和阿糖胞苷)。所有达到完全缓解(CR)或部分缓解(PR)的患者均接受了高剂量阿糖胞苷巩固治疗。主要终点为诱导治疗后复合完全缓解率(CRc),包括初始和再诱导治疗后的CR和CR伴不完全血液学恢复(CRi)。次要终点包括≥3级感染的发生率、严重骨髓抑制的持续时间、无事件生存(EFS)、总生存(OS)和诱导后可测量残留病(MRD)阴性率。
研究结果
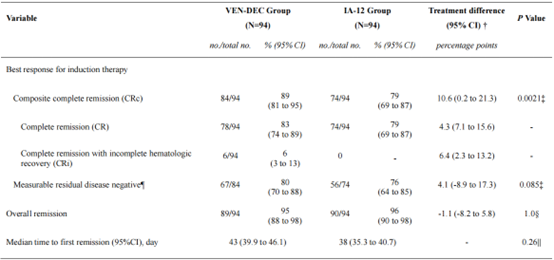
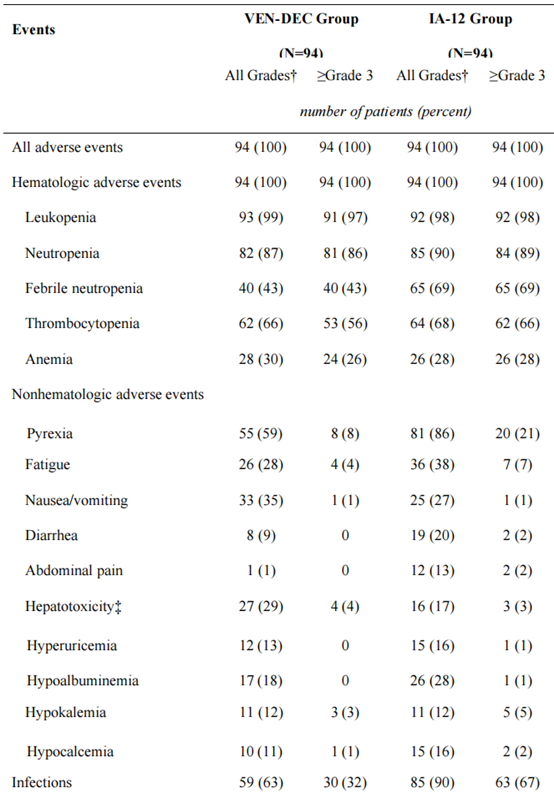
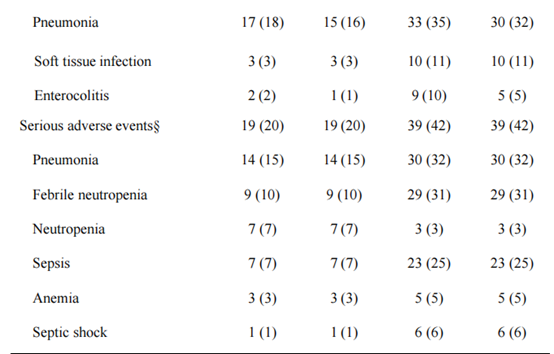
研究共筛选了255例患者,最终188例患者入组并随机分配,每组94例。在意向治疗人群中,VEN-DEC组的CRc率为89%,而IA-12组为79%,显示出VEN-DEC的非劣效性(P=0.0021)。在诱导后,VEN-DEC组的MRD阴性率为80%,而IA-12组为76%。在特定亚组中,VEN-DEC在≥40岁患者、具有不良风险基因或表观遗传突变的患者中表现出更高的CRc率,但在RUNX1::RUNX1T1融合病例中表现较差。安全性分析表明,VEN-DEC组的治疗相关严重不良事件(SAEs)发生率显著低于IA-12组(20% vs. 42%,P=0.003)。具体来说,VEN-DEC组的≥3级感染发生率较低(32% vs. 67%),严重血小板减少的持续时间较短(中位13天 vs. 19天,P<0.001)。此外,VEN-DEC组的中性粒细胞减少性发热(43% vs. 69%,P<0.001)和败血症(7% vs. 25%,P=0.002)的发生率也显著降低。这些结果表明,VEN-DEC在安全性方面优于传统的强化化疗。

结论
本研究表明,VEN-DEC在年轻AML患者中表现出与IA-12相当的反应率,并且在安全性方面具有优势。特别是对于具有不良风险基因的患者,VEN-DEC可能是一个可行的替代方案。然而,在RUNX1::RUNX1T1融合的患者中,VEN-DEC的反应率较低,提示在这些患者中可能需要继续使用传统的强化化疗。
原始出处
Lu J, Xue SL, Wang Y, et al. Venetoclax and Decitabine vs Intensive Chemotherapy as Induction for Young Patients with Newly Diagnosed AML. Blood. 2024; doi: 10.1182/blood.2024027217.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言
















#AML# #地西他滨# #维奈克拉#
7