Cell Metab:武汉大学闫卫等发现花生四烯酸触发原发性肿瘤分泌亚精胺合酶,从而在照射后诱导骨骼肌无力!
2025-06-22 iNature iNature 发表于上海
该研究发现癌细胞通过细胞外囊泡分泌更多的亚精胺合酶(SRM)来引发放疗后的骨骼肌无力。
放射治疗降低了癌症复发和死亡的风险,但它伴随着包括肌肉纤维化和虚弱在内的多种副作用,这一事实严重影响了患者的生活质量。然而,其潜在的机制还不清楚。
2025年6月19日,武汉大学闫卫、华中科技大学Zhao Yanxia共同通讯在Cell Metabolism在线发表题为“Arachidonic acid triggers spermidine synthase secretion from primary tumor to induce skeletal muscle weakness upon irradiation”的研究论文,该研究发现癌细胞通过细胞外囊泡分泌更多的亚精胺合酶(SRM)来引发放疗后的骨骼肌无力。
从机制上来说,辐射引发的花生四烯酸(ArA)积累提高了SRM蛋白的异糖基化,促进SRM包装到原发性肿瘤的细胞外囊泡中。循环SRM以eIF5A依赖的方式导致骨骼肌中亚精胺的积累和I型胶原纤维的生物合成。然而,氯沙坦治疗阻断SRM的异糖基化及其随后的分泌。总的来说,该发现确定了ArA在放疗时与循环SRM分泌协同作用,这通过重新连接多胺代谢加重了骨骼肌纤维化,当与氯沙坦联合治疗时,减轻了放疗介导的肌肉无力。

放射治疗(RT)是一种有效的细胞毒性疗法,可用于治疗局部实体癌,降低癌症复发和死亡的风险。尽管在临床放射治疗中物理剂量给药方案取得了更多成就,但副作用仍然不可避免,导致放射治疗的终止。例如,放射激活肿瘤微环境中的免疫抑制途径,引发导致转移形成的过程。癌症患者在放射治疗后表现出明显的肌肉无力和萎缩,降低了患者的生活质量。细胞外基质(ECM)成分(尤其是胶原)的异常积累会导致纤维化。骨骼肌纤维化诱导基质结构的病理变化,导致肌肉生物力学特性的失调。鉴于此,肌肉纤维化也被认为是肌肉无力的主要原因。骨骼肌纤维化是肌营养不良、衰老和严重肌肉损伤的标志。因此,对肌肉纤维化机制的更好理解将有助于在这些病理条件下开发创新的抗纤维化疗法。
细胞部分通过分泌细胞外囊泡(EVs)相互交流。外泌体,直径为40-150nm的内涵体衍生小EVs,通过转移蛋白质、代谢物和核酸生物分子促进细胞间通讯。将这些货物分类为小EVs的机制取决于不同的机制。例如,一些核酸依赖于RNA结合蛋白的识别,蛋白质货物需要运输所需的内体分选复合体以及额外的翻译后修饰(PTMs),如泛素化和棕榈酰化。值得注意的是,ISG酸化是由干扰素刺激的基因介导的泛素化样PTM过程。以前的报告支持ISG酸化与EV释放有关,但它们在EV-蛋白质货物分选中的作用尚不清楚。
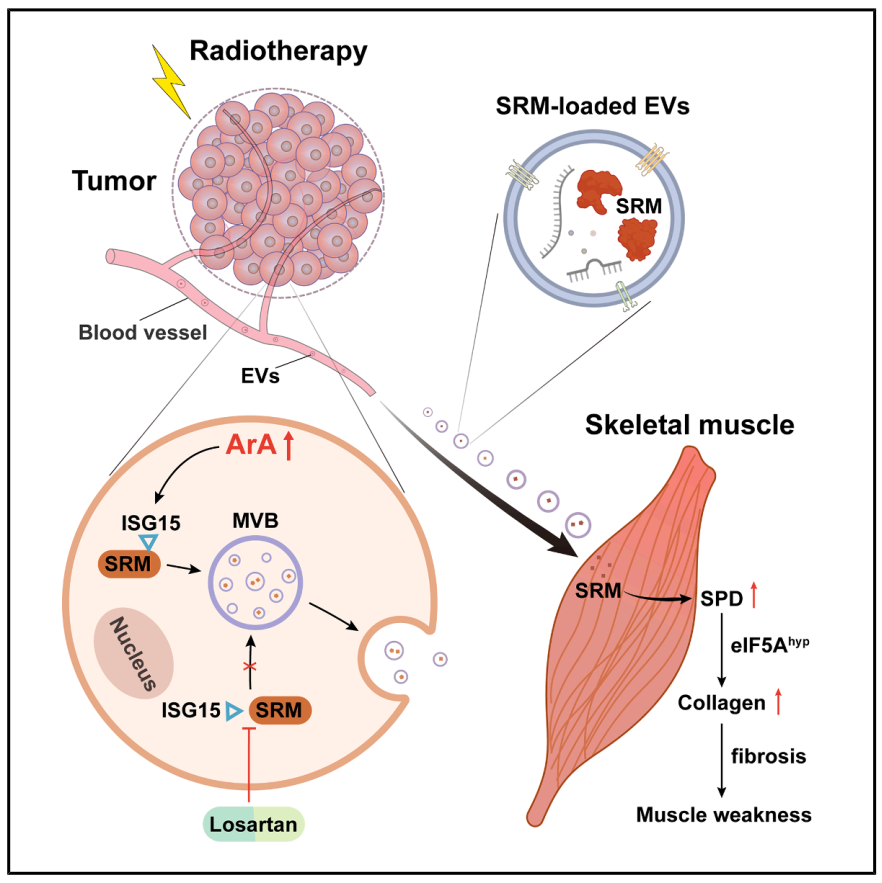
机理模式图(图源自Cell Metabolism)
在这里,研究人员报道了放射治疗后花生四烯酸的升高增强了包裹亚精胺合酶的小细胞外囊泡向肌肉的转移,驱动了高利用依赖性胶原沉积和骨骼肌无力。氯沙坦抑制亚精胺合酶的糖基化及其随后的细胞外囊泡分泌,以缓解肌肉无力。总之,该研究发现放疗诱导的花生四烯酸(ArA)增强SRM ISG糖基化,促进其通过EV分泌,导致骨骼肌纤维化。靶向循环SRM将是减少癌症放疗副作用的有前途的治疗策略。
参考信息:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(25)00269-4
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言















#花生四烯酸# #亚精胺合酶#
16 举报