中山大学吴小剑/高峰/毛苡泽团队《自然·通讯》研发结直肠癌精准风险分层“导航系统”PIANOS,重塑个体化治疗决策
昨天 BioMed科技 BioMed科技 发表于上海
研究开发 PIANOS 模型,基于通路对相对排序实现结直肠癌个体化风险分层,预测性能优于现有模型,可指导治疗策略选择。
摘要
结直肠癌(CRC)的预后和治疗反应存在显著的个体差异,亟需稳定且可靠的生物标志物指导临床决策。然而,现有基于转录组的预后模型普遍受限于平台异质性和批次效应,临床转化困难。近日,中山大学附属第六医院吴小剑教授、高峰研究员及中山大学肿瘤防治中心毛苡泽主治医师团队在Nature Communications发表了题为“Personalized risk stratification in colorectal cancer via PIANOS system”的研究论文。
该研究开发了一种名为PIANOS(PlatformIndependent AndNormalization free Single-sample classifier)的创新风险分层模型。该模型基于通路富集评分和k-Top Scoring Pairs(k-TSP)算法,实现了对单个样本的精准风险评估,且无需跨平台数据标准化。在涉及8个国家、15个独立队列、共计3666名CRC患者的大规模验证中,PIANOS展现了卓越且稳健的预后预测能力(总体C-index=0.74),并优于105个已发表模型。更重要的是,多组学分析揭示了不同风险亚型在基因组、转录组及肿瘤免疫微环境(TME)层面的显著差异,并指明了其对化疗、抗血管生成治疗及免疫治疗的不同潜在敏感性,为CRC的个体化治疗提供了强有力的理论依据和临床决策工具。
研究背景
结直肠癌(CRC)是全球高发的主要恶性肿瘤之一,其临床结局具有高度异质性。经典的TNM分期系统虽能评估肿瘤负荷,却无法充分反映肿瘤内在的生物学行为,导致同分期患者的预后和治疗反应差异巨大。因此,开发精准的分子分型工具以辅助临床决策、实现个体化治疗,是改善CRC患者生存现状的关键。
近年来,高通量测序技术催生了大量基于转录组数据的预后模型。然而,这些模型的临床转化之路步履维艰,主要瓶颈在于:1)平台依赖性:多数模型在特定基因芯片或RNA测序平台上开发,跨平台应用时性能急剧下降;2)批次效应与数据标准化:不同研究中心、不同时间获取的数据间存在难以消除的批次效应,而传统的数据标准化(Normalization)方法在处理单个新样本时,又可能引入偏倚,影响预测的准确性。这些技术难题严重制约了模型的临床泛化能力和实用价值。
PIANOS模型的构建与性能验证
为攻克上述难题,研究团队独辟蹊径,构建了PIANOS分类器。其核心策略是将分析单元从“基因”提升至“通路”,将比较方式从“绝对定量”转为“相对排序”。
具体构建流程分为三步:
通路富集分析:首先,对单个样本的基因表达谱进行单样本基因集富集分析(ssGSEA),将其转化为包含22,596个生物学通路的富集分数谱。
核心算法筛选:随后,采用k-Top Scoring Pairs (k-TSP)算法。该算法在样本内寻找能稳定区分高、低风险结局的“通路对”(Pair),只比较这两个通路的富集分数高低,而不依赖其绝对值。这种相对排序机制是模型能够抵抗平台差异和批次效应的关键。
模型整合与稳定化:通过在训练集中进行100次重采样,筛选出在测试集上平衡准确率高于0.6的稳定“通路对”,最终整合构建成PIANOS分类器。
研究团队在来自8个国家、15个独立队列(n=3666)中对PIANOS进行了系统性验证。结果表明,PIANOS不仅能稳定、准确地区分高、低风险患者(p<0.001),其总体预测性能(C-index=0.74, 95% CI=0.71-0.76)也全面超越了研究团队收集和复现的105个已发表CRC预后模型。多变量Cox回归分析证实,PIANOS分型是独立于TNM分期、MSI状态、年龄、性别等临床病理特征的强大预后预测因子。此外,模型在基因信息缺失高达50%的情况下,性能仅出现轻微下降,显示了其卓越的鲁棒性。
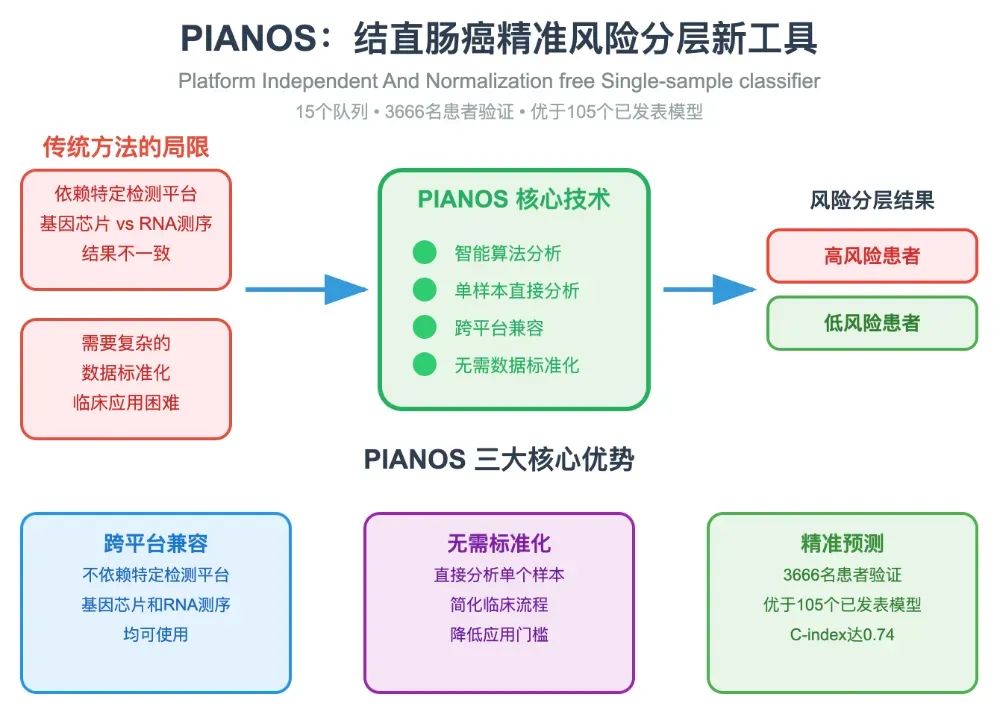
图1.PIANOS模型工作原理示意图
PIANOS分型的多组学特征与生物学机制解析
为了解PIANOS风险分层背后的生物学基础,研究团队进行了深入的多组学整合分析。
转录组与通路层面:高风险组显著富集了与肿瘤侵袭、转移相关的通路,如上皮间质转化(Epithelial-mesenchymal transition, EMT)、血管生成(Angiogenesis)和TGF-β信号通路。这与临床上更差的预后表型高度一致。相比之下,低风险组则表现出G2M检查点、IFN-α/γ干扰素应答等抗肿瘤免疫相关通路的显著激活。值得注意的是,PIANOS分型与国际公认的CMS(Consensus Molecular Subtypes)分型高度相关,其中预后最差的CMS4(间质型)主要富集于PIANOS高风险组。
基因组层面:通过对TCGA、COCC等多个队列的突变数据进行分析,发现在高、低风险组间存在差异性的突变图谱。例如,MUC16和FSIP2的突变频率在低风险组中显著更高,而既往研究表明这些突变与更强的免疫原性和更好的免疫治疗预后相关。相反,高风险组中与EMT和血管生成相关的SMAD4和TP53突变频率更高。
肿瘤免疫微环境(TME):低风险组展现出典型的“免疫热”肿瘤特征。无论是通过xCell算法推算的免疫细胞浸润丰度,还是通过分析H&E染色图像评估的肿瘤浸润淋巴细胞(TILs)数量,低风险组均显著高于高风险组。此外,低风险组的肿瘤突变负荷(TMB)、新抗原数量、T细胞受体(TCR)多样性以及细胞毒性T细胞(CTL)活性评分也显著更高。相反,用于预测免疫治疗抵抗的TIDE(Tumor Immune Dysfunction and Exclusion)评分在低风险组中显著更低。这些证据共同表明,PIANOS低风险患者拥有一个更有利于抗肿瘤免疫应答的微环境。
PIANOS指导下的个体化治疗策略探索
基于上述生物学差异,研究团队进一步探索了PIANOS分型对不同治疗方案敏感性的预测价值。
化疗:低风险组中富集的G2M检查点通路是多种化疗药物的作用靶点。研究发现,低风险患者肿瘤组织中的增殖标志物Ki67水平更高,并且在多个队列中,低风险患者接受辅助化疗后的生存获益(DFS改善)显著优于高风险患者。
抗血管生成治疗:高风险组中显著激活的血管生成通路以及VEGFA的高表达,提示其可能对以贝伐珠单抗为代表的抗血管生成药物更为敏感。在对一个接受贝伐珠单抗治疗的IV期CRC患者队列的分析中,高风险患者确实展现出比低风险患者更显著的生存获益(p=0.019)。
免疫治疗:低风险组的“免疫热”肿瘤特征预示着其对免疫检查点抑制剂(ICI)治疗的良好反应。研究团队在7个外部ICI治疗队列(包含黑色素瘤、肺癌、肾癌等多个癌种)中验证了PIANOS的预测能力。结果一致显示,被PIANOS划分为低风险的患者,其客观缓解率(ORR)和总生存期(OS)均显著优于高风险患者。
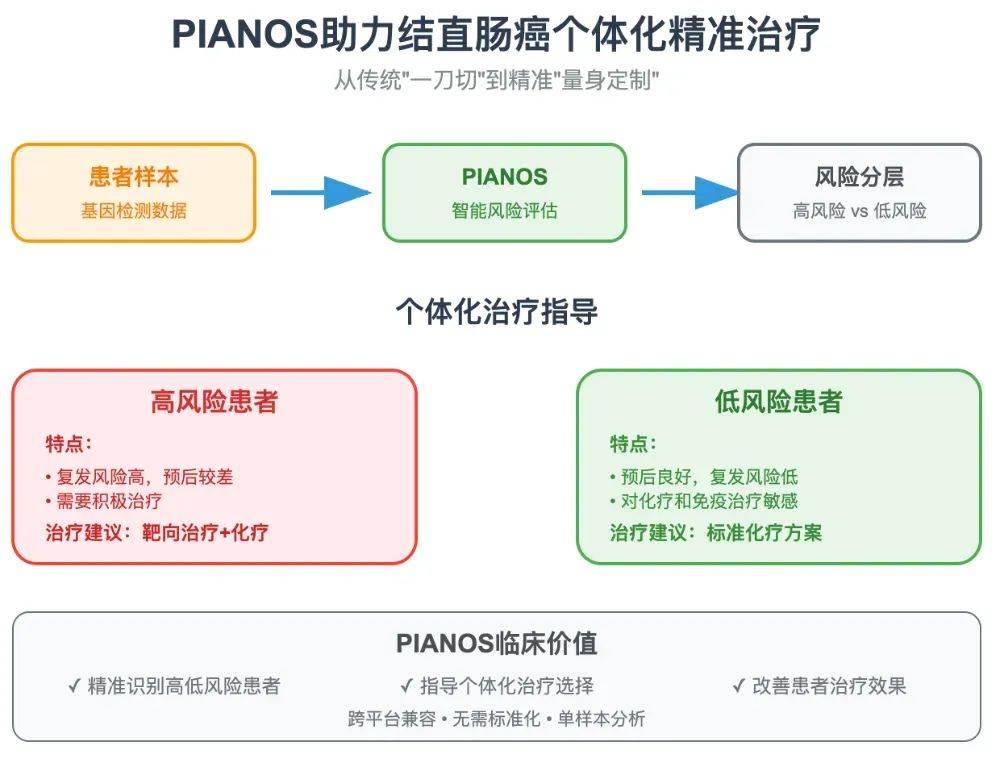
图2.PIANOS的临床应用价值示意图
【总结与展望】
本研究成功开发并验证了一个平台独立、无需标准化的新型结直肠癌风险分层模型PIANOS。它通过创新的k-TSP算法,有效克服了现有分子分型工具在临床应用中的主要障碍。大规模多中心数据验证了其卓越的预后预测能力和鲁棒性。更深远地,该研究通过多组学分析,系统阐明了不同风险亚型在分子和免疫层面的生物学全景,并揭示了其对不同治疗策略的潜在敏感性差异,为实现结直肠癌的个体化精准治疗提供了强有力的决策依据和转化工具。未来,开展基于PIANOS分层的前瞻性临床试验,将是推动其最终服务于临床、改善患者预后的关键一步。
作者信息
中山大学附属第六医院蔡都博士后、祁皓宁博士后,中山大学肿瘤防治中心杨秋霞主治医师、李华宇医师为本文共同第一作者。中山大学附属第六医院吴小剑教授、高峰研究员与中山大学肿瘤防治中心毛苡泽主治医师为共同通讯作者。

原文链接:
https://doi.org/10.1038/s41467-025-61713-1
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言



















#结直肠癌# #PIANOS#
3 举报