J Adv Res 曾春雨/吴庚泽/陈良龙教授团队发现细胞骨架相关蛋白作为VSMC表型转化“检查点”抵抗血管病理重构
2025-07-01 论道心血管 论道心血管 发表于上海
本研究构建了一个跨物种综合的VSMC单细胞RNA测序模型,绘制了血管病理重构过程中VSMC在病理刺激下发生表型转化的保守轨迹,进一步深化了对VSMC可塑性的理解。
血管平滑肌细胞(Vascular smooth muscle cell, VSMC)作为血管壁主要构成细胞类型之一,在包括动脉粥样硬化、动脉瘤等泛血管疾病背景下发生动态和复杂的细胞表型变化过程。这一病理过程伴随VSMC收缩功能的丢失,被称为VSMC表型转化(Phenotypic Switching)。近年来多项研究借助单细胞转录组测序技术识别了疾病相关不同种类的细胞亚群,然而VSMC表型转化发生早期过程中可能作为治疗靶点的抵抗因素仍不明确。
2025年6月12日,陆军军医大学曾春雨教授、吴庚泽副教授和福建医科大学陈良龙教授共同指导的题为“Cytoskeletal-related Genes Function as Checkpoints for the Maintenance of VSMC Contractile Phenotype and Prevent Pathological Remodeling in Arterial Diseases”的研究论文在生物学期刊Journal of Advanced Research上在线发表。研究通过基于整合泛血管疾病背景下多个单细胞数据集的生物信息学分析,进一步详细研究了细胞骨架相关基因Fblim1、Tns1以及Synpo2 (下称“三基因”)在VSMC表型转化过程中影响细胞骨架组装的关键作用,并通过在体实验显示了以“鸡尾酒策略”干预“三基因”具有良好的抗VSMC表型转化作用,有望成为病理重构相关泛血管疾病的潜在治疗靶点。

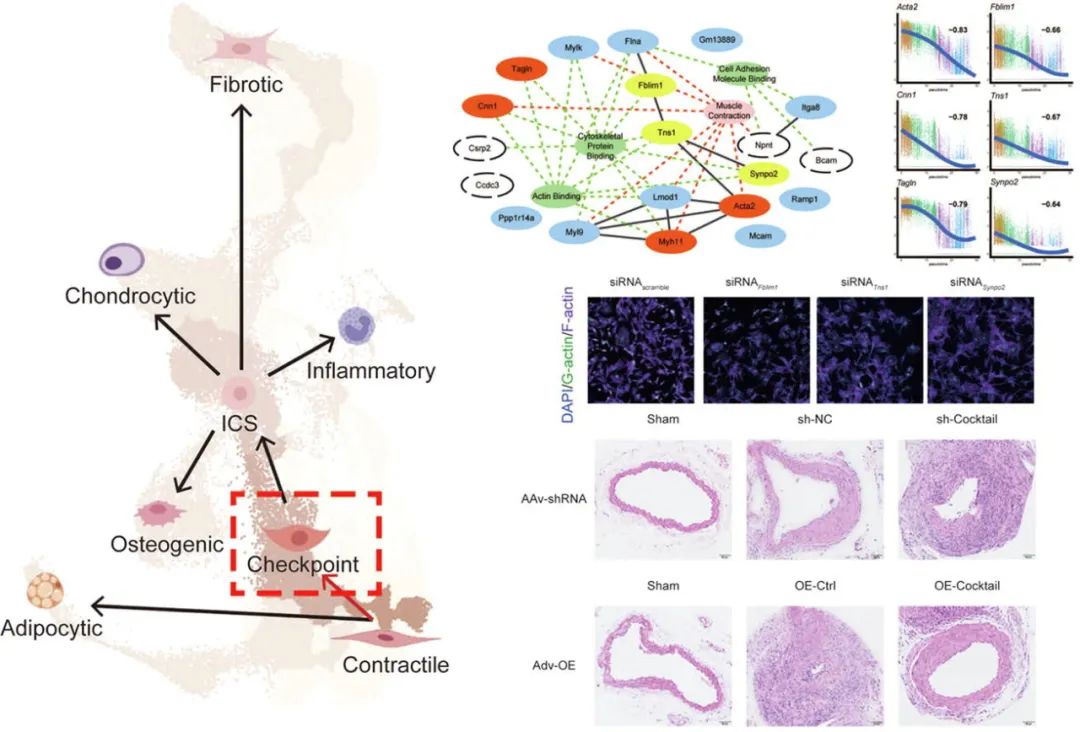
首先,研究团队通过对已发表的小鼠与人动脉粥样硬化斑块以及动脉瘤单细胞测序数据集进行跨物种整合分析,借助小鼠谱系示踪标记构建了针对VSMC谱系细胞的转化轨迹,在根据功能富集分析与标志基因定义跨数据集共享的收缩型、软骨型、成骨型、促炎型、脂肪型以及成纤维型等VSMC转化终点亚群的同时,根据各终点的共享转化路径以及既往研究指出的重要表型转化相关基因表达趋势,确定了转化中间态细胞亚群(ICS),并进一步关注在转化起点(收缩型VSMC)与中间态之间存在的表型转化“检查点”(Checkpoint)亚群。
研究团队进一步根据整合的转化路径基因分析与“检查点”相关差异表达基因分析,寻找VSMC表型转化早期发生改变的关键分子,发现与细胞骨架结构形成功能相关的“三基因”Fblim1、Tns1以及Synpo2在血管表型转化轨迹中具有明显改变。通过内部与外部数据验证证实收缩功能蛋白(αSMA、CNN1,SM22α)基因表达变化与细胞骨架相关基因表达趋势具有较好的一致性。对小鼠动脉瘤模型标本以及PDGF-BB诱导的原代平滑肌细胞表型转化模型标本进行mRNA与蛋白表达水平的检测,验证了收缩功能蛋白与“三基因”表达水平的一致改变。
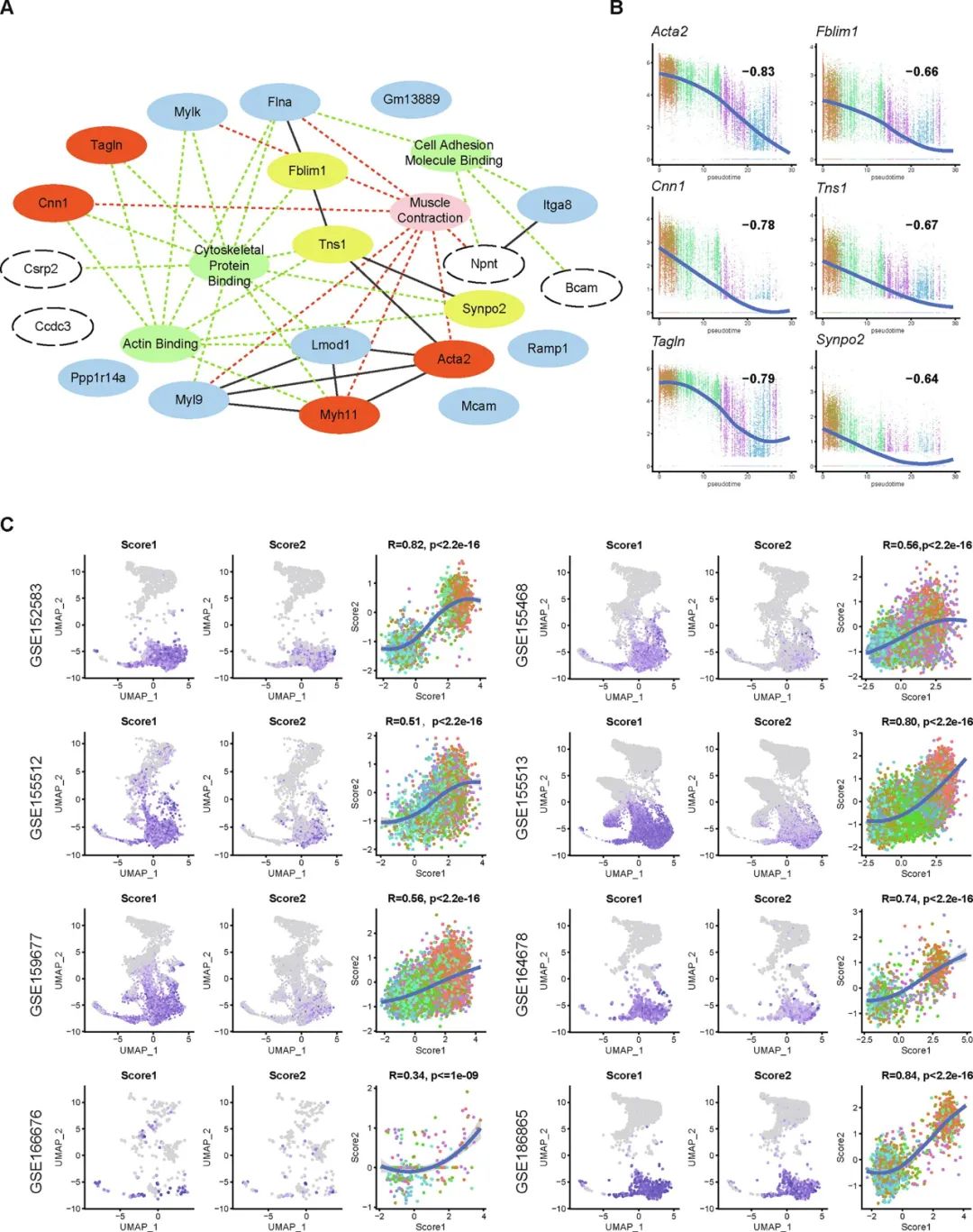
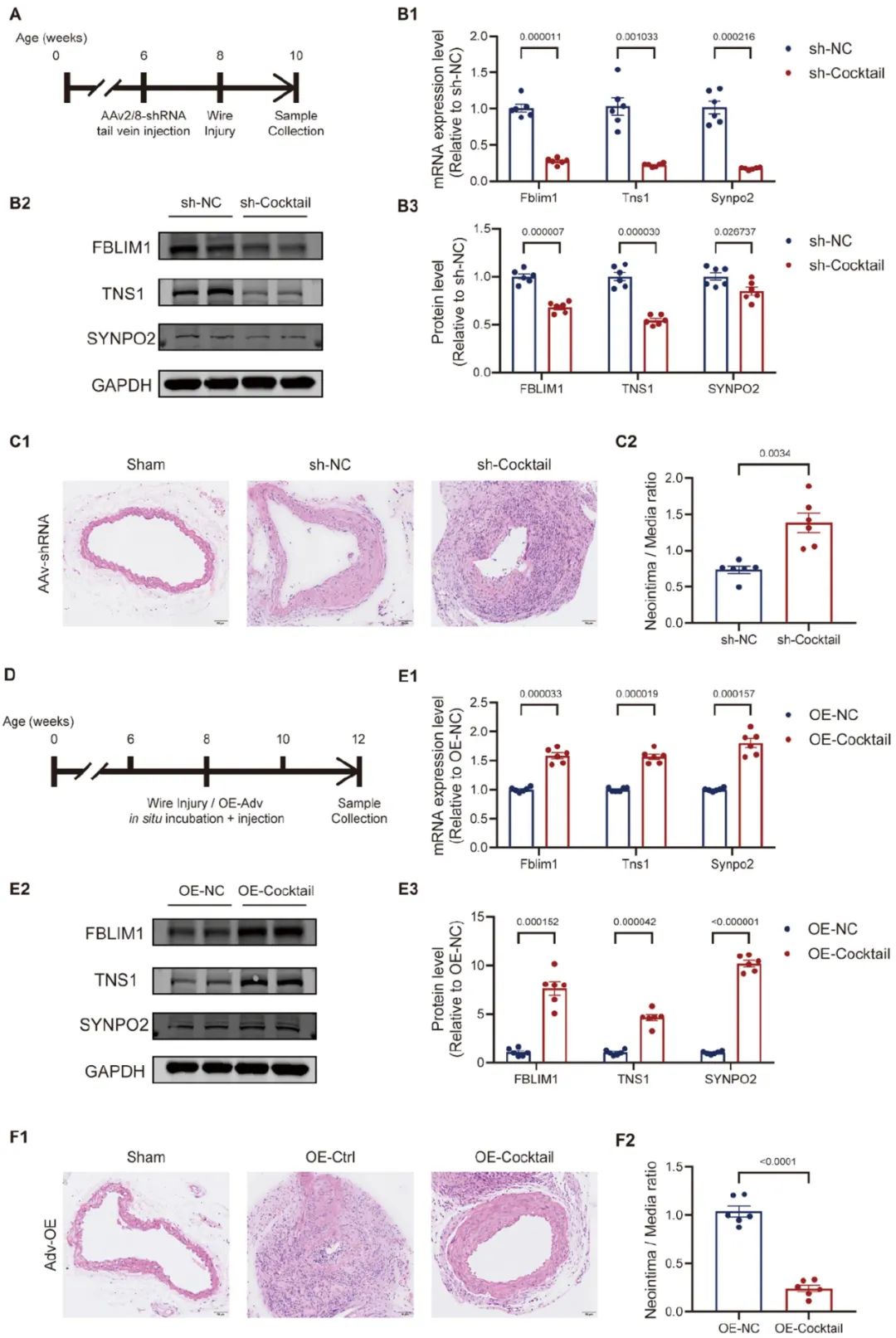
为探究上述“三基因”对于VSMC表型转化的影响,研究团队在小鼠主动脉原代平滑肌细胞中通过siRNA分别干扰“三基因”,并检测了基因敲降对收缩态功能蛋白表达水平、细胞增殖、迁移能力发现三基因分别敲除后均促进VSMC表型转化的进展并且影响细胞骨架的正常组装。为进一步验证“三基因”的临床转化意义,研究团队在小鼠颈动脉线损伤这一经典血管重构模型中通过“鸡尾酒”策略将“三基因”进行敲降与过表达,结果提示AAV2/8-shRNA敲降“三基因”明显加重了血管病理重构,而通过腺病毒进行“三基因”原位过表达显著减轻了血管病理性重构的进展。
综上,本研究构建了一个跨物种综合的VSMC单细胞RNA测序模型,绘制了血管病理重构过程中VSMC在病理刺激下发生表型转化的保守轨迹,进一步深化了对VSMC可塑性的理解;同时提出细胞骨架相关“三基因”Fblim1、Tns1以及Synpo2可以作为血管病理重构中的“检查点”,可能通过维持细胞骨架正常结构,保持VSMC收缩态表型,可能作为血管病理重构相关泛血管疾病的重要转化靶点。
陆军军医大学大坪医院心内科曾春雨教授、吴庚泽副教授和福建医科大学附属协和医院心血管内科陈良龙教授为本文的通讯作者。刘运畅主治医师、曾利平助理研究员、蔡琦博士以及曾云飞硕士研究生为本文第一作者。本研究得到国家自然科学基金委青年基金项目、区域创新发展联合基金重点支持项目(82100378、U24A20649)、国家卫健委“四大慢病”防治研究国家科技重大专项(2024ZD0527100)和重庆市自然科学基金委杰出青年项目、重点项目(2025GGXM002、CSTB2022NSCQ-LZX0037)的支持。
原文链接:
https://doi.org/10.1016/j.jare.2025.05.065
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















#血管平滑肌细胞# #VSMC#
3 举报