【衡道丨病例】病理诊断——小肠系膜SMARCA4缺失的未分化肿瘤
2025-05-24 衡道病理 衡道病理 发表于上海
本期,williamhill asia 将通过1例小肠系膜SMARCA4缺失的未分化肿瘤的病例为大家详解SMARCA4缺失的未分化肿瘤的病理诊断知识。
病史介绍
男性,67岁,因“腹部胀痛4+天”入院。
辅助检查
胸腹部CT:
右下腹见约41x37mm高密度团块,密度不均,CT值51HU,增强壁强化,其余未见强化,与邻近小肠关系密切,周围脂肪间隙少量絮状影,其上方小肠充气、扩张并多发液平,远侧小肠及大肠干。
考虑:
1.右侧肠系膜肿瘤伴小肠机械性肠梗阻,盆腔少量积液;
2.右肺上叶周围型肺ca伴右肺门及淋巴结转移,累及右侧胸膜。
组织病理活检1、大体肉眼观:肠管一段,长10cm,管径3.0cm,粘膜光滑未见明显肿块,肠管中段系膜处见一包块,4.5*4*3.5cm,切面灰红,质软,与周围组织分界不清。
2、镜下观:
瘤细胞弥漫片状,细胞单一性的、卵圆形的,圆形到上皮样细胞组成,肿瘤细胞具有泡状核和明显的核仁,拥有丰富的嗜酸性细胞质和明显的核仁。部分细胞呈横纹肌样细胞,常有胞浆内包涵体和偏心位核,核分裂象活跃,伴有大量凋亡碎片的地图样坏死区域。
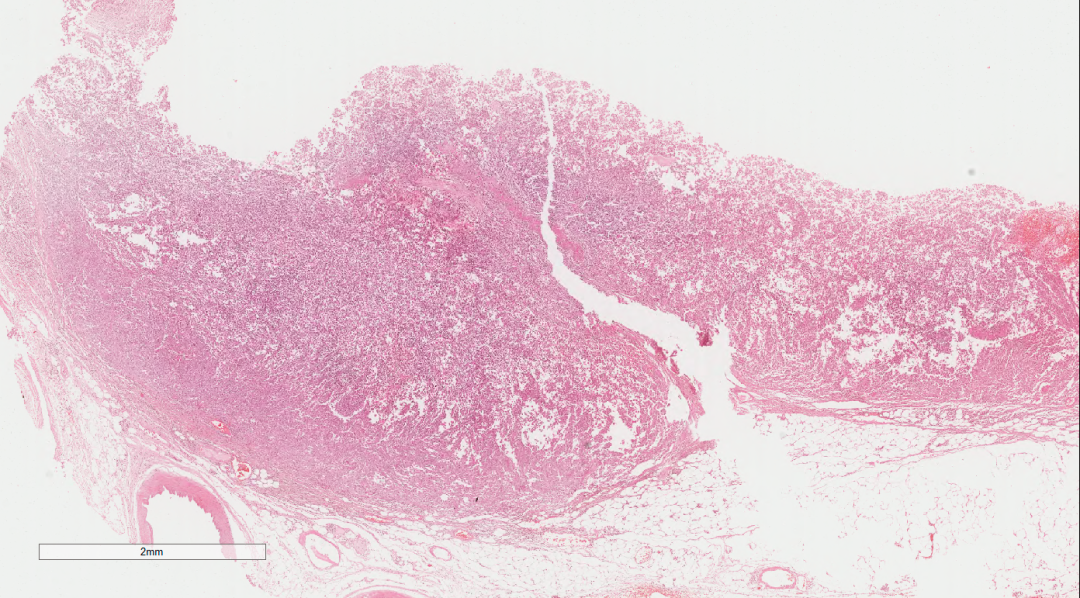
图1 低倍镜下肿瘤弥漫成片
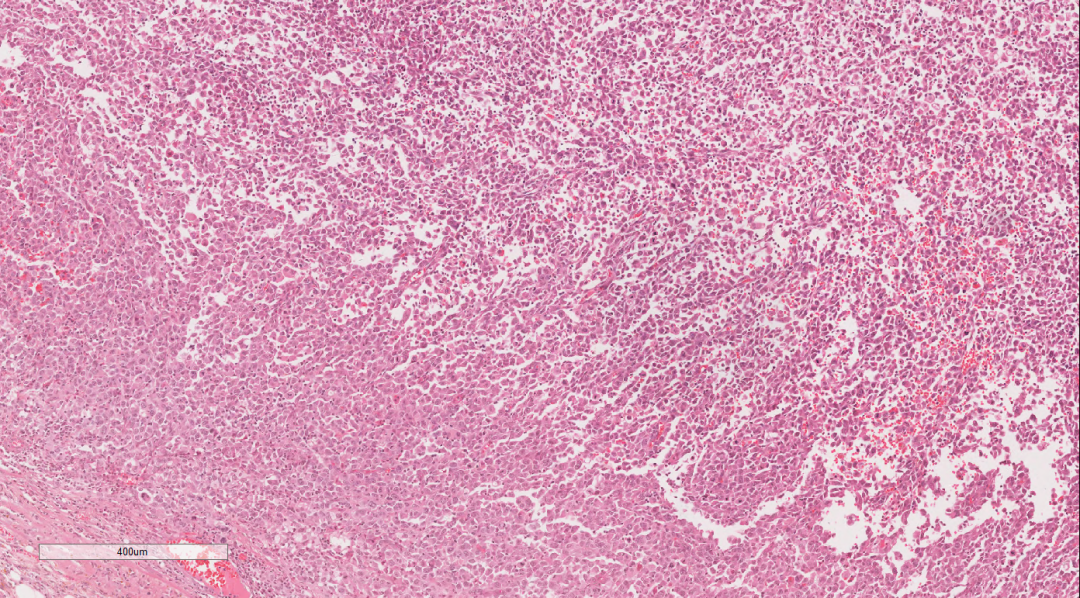
图2 低倍镜下见肿瘤表现弥漫片状,部分呈上皮样,部分呈梭形,横纹肌样
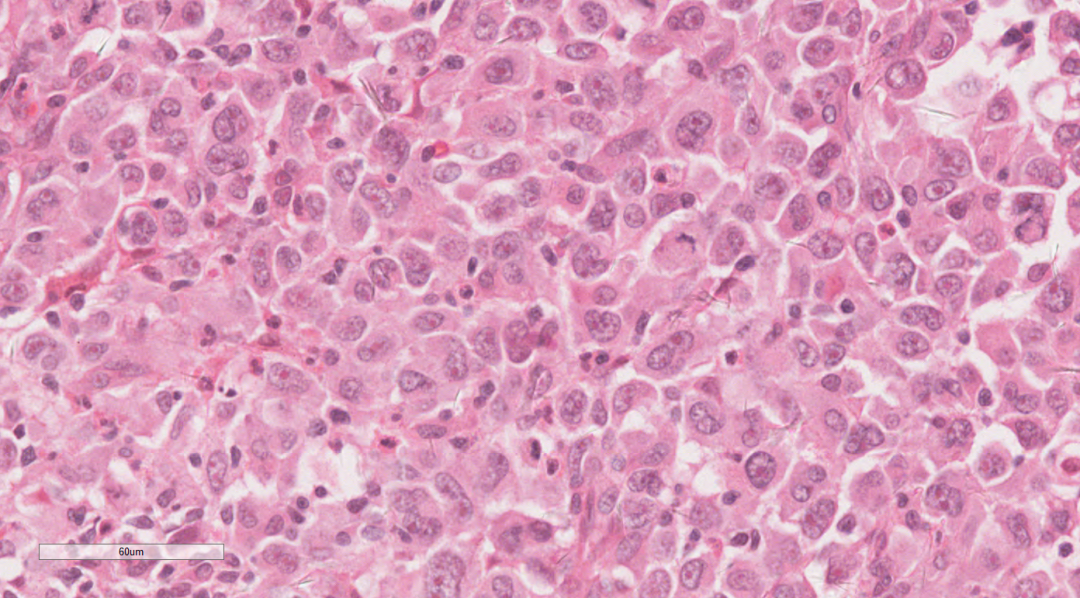
图3 高倍镜下,肿瘤上皮样区域
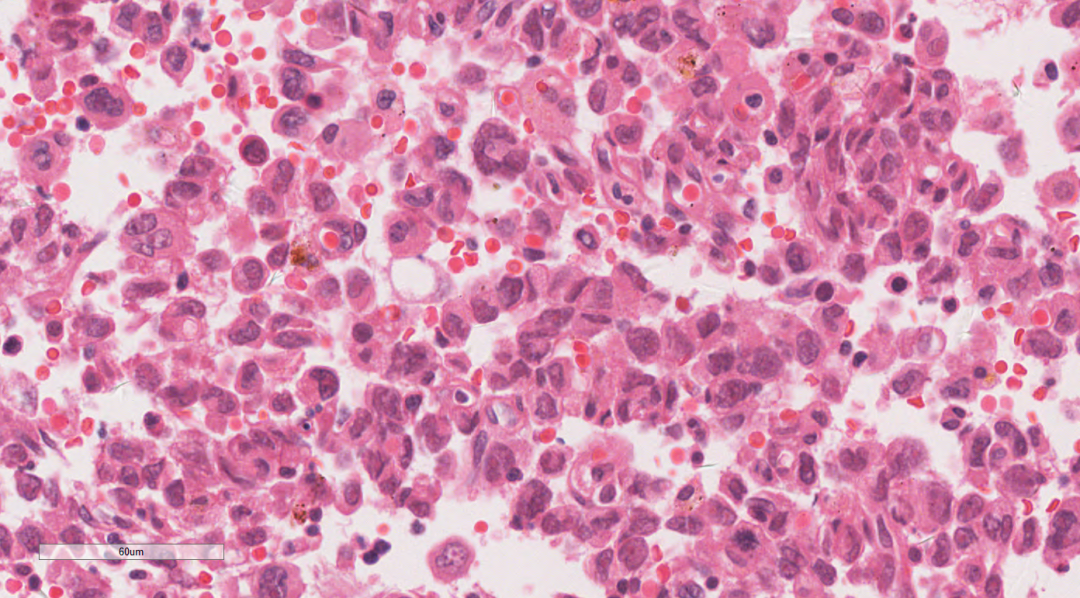
图4 高倍镜下肿瘤细胞部分表现瘤巨细胞和横纹肌样
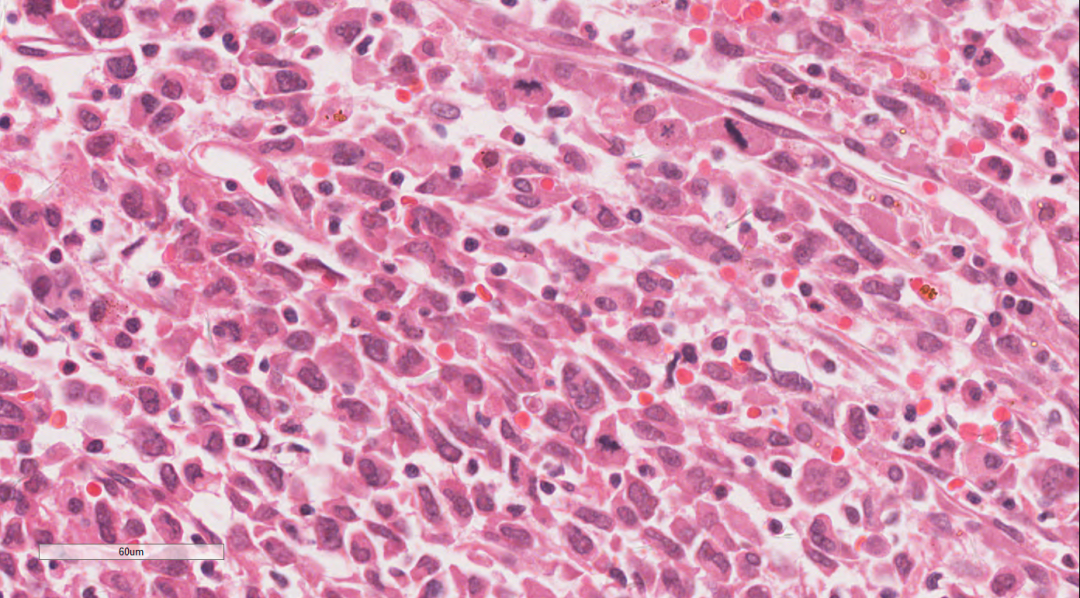
图5 高倍镜下肿瘤细胞部分为低黏附性的梭形或横纹肌样
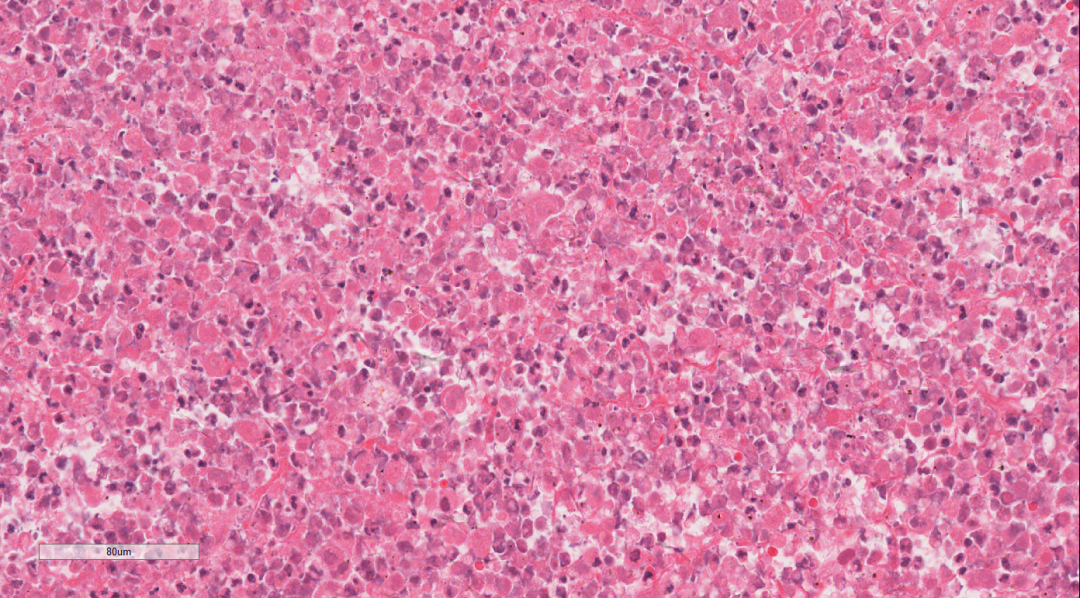
图6 肿瘤部分区域可见坏死,散在核碎片
3、免疫组化:
肿瘤细胞Vimentin(+),BRG1(-,炎细胞和血管内皮细胞作为内对照呈核阳性) ,CD34(+),CK(部分+),CD10(部分+),ki67(80%+),CK7(-),TTF1(-),P40(-),Bcl-2(-),CD15(-),CD20(-),CD3(-),CD21(-),CD30(-),c-Myc(-),cyclinD1(-),HMB45(-),Melan-A(-),MUM1(-),EMA(-),CD117(-),CDX2(-),Dog-1(-),SDH(未见缺失),INI-1(未见缺失),SMA(-),Calretinin(-),WT1(-),CD31(-),F8(-),ERG(-),Fli-1(-),Galectin-3(-),Hepatocyte(-)。
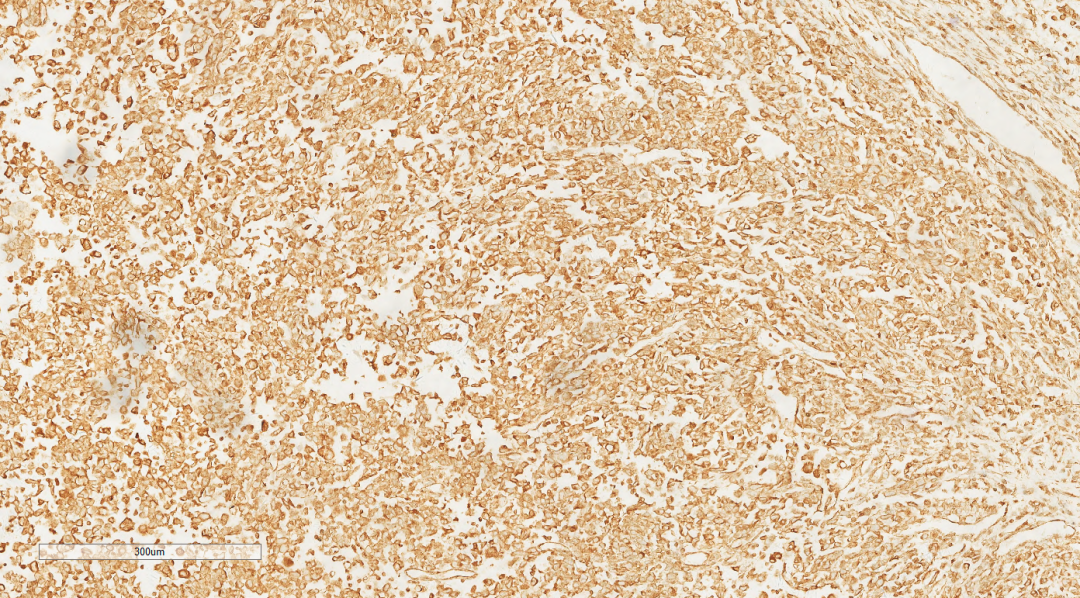
图7 免疫组化示肿瘤细胞Vimentin(+)
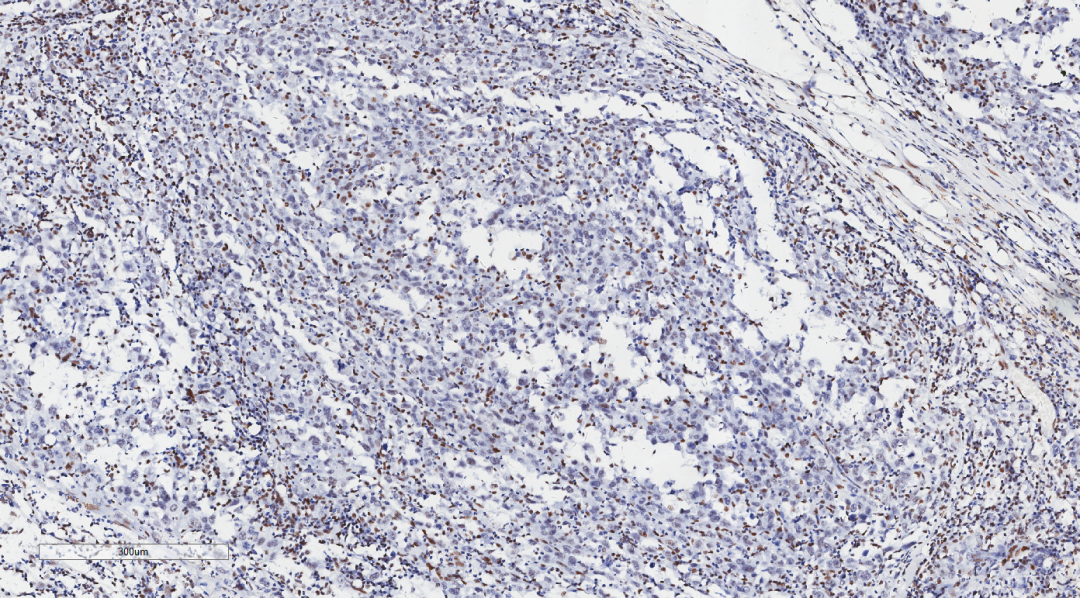
图8 免疫组化示肿瘤细胞BRG1(-,炎细胞和血管内皮细胞作为内对照呈核阳性)
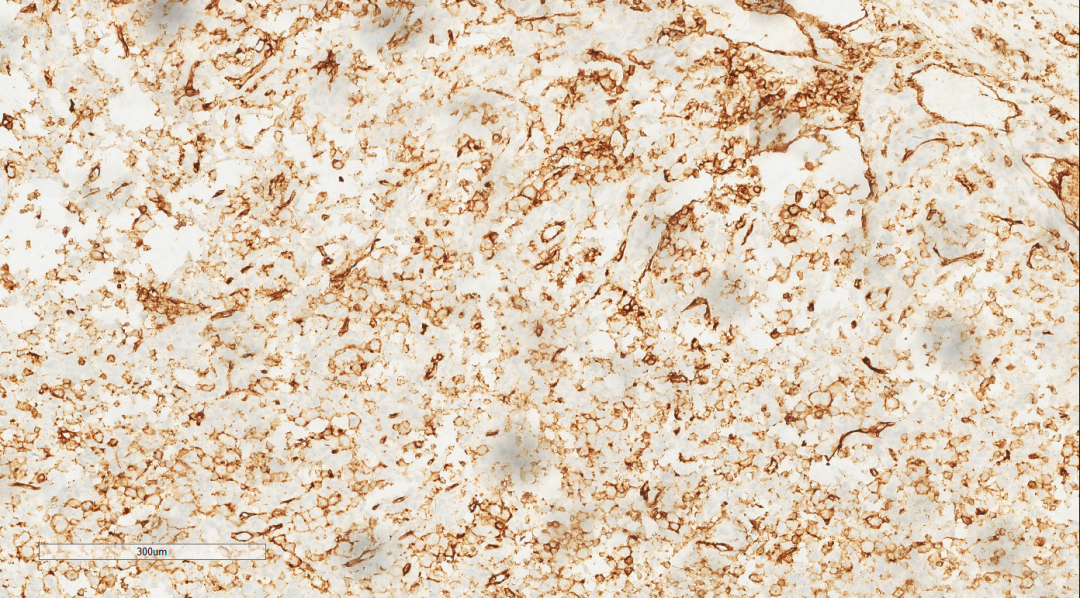
图9 免疫组化示肿瘤细胞CD34(+)
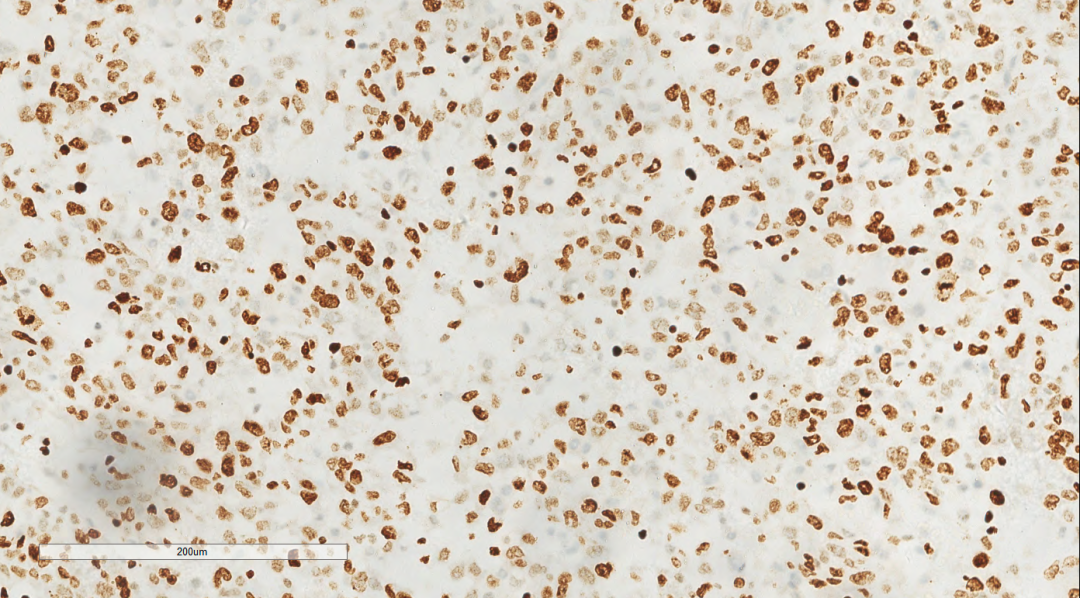
图10 免疫组化示肿瘤细胞Ki-67(约80%+)
病理诊断
(小肠系膜)SMARCA4缺失的未分化肿瘤。
讨论
1、背景
SMARCA4缺陷型未分化肿瘤(SMARCA4-UT),也曾被称为SMARCA4缺失的原发性肉瘤或SMARCA4缺陷型肉瘤。一系列研究阐明了BAF(也称为SWI / SNF)染色质重塑蛋白复合物的分子致癌性作用。BAF(SWI / SNF)复合物的缺失由SMARCA4编码亚基,也称为Brahma相关基因1(BRG1),是由Wong等人在2000年提出,在前列腺、乳腺和胰腺癌中均显示出该基因的抑癌作用。2003年,Reisman等人发现SMARCA4缺失偶尔出现在非小细胞肺癌(NSCLC)中,并与较差的预后相关。2015年,Le Loarer等人描述了一系列病例(19例患者),其中大多数是年轻男性吸烟者。这些患者被发现胸腔内迅速增大的肿块、具有横纹肌样形态特征、免疫组化显示未分化的免疫表型,以及SMARCA4缺失,并且侵袭性非常强。
由于这些肿瘤在转录上与BAF缺陷型肉瘤更相似,因此Le Loarer提出了一个术语,即“SMARCA4缺陷型胸腔肉瘤(DTS)”用于命名这种新近描述且具有非常独特临床病理特征的肿瘤。SMARCA4缺陷也偶见于其他许多肿瘤,包括肺癌,以及发生于鼻窦,子宫内膜和胃肠道的肿瘤,表现为肿瘤局灶性去分化特征,呈横纹肌样。Rekhtman等人的最新研究提供了关于SMARCA4-DTS在形态学、免疫组化、基因改变方面的证据,提示SMARCA4-DTS可能实际上代表一种与吸烟相关的肉瘤样/未分化癌。
新的2021年第5版WHO胸部肿瘤分类新增SMARCA4缺失的未分化肿瘤(SMARCA4-UT)来描述先前被称为“SMARCA4-DTS”的一组肿瘤,该肿瘤具有未分化的形态和高度的侵袭性。SMARCA4-UT是侵犯成人胸部的高级别恶性肿瘤,表现为未分化或横纹肌样表型和存在BAF染色质重塑复合物关键成员SMARCA4的缺失。2021年第5版肺部肿瘤WHO分类将SMARCA4-UT与NUT癌一起被归入“肺的其他上皮源性肿瘤”。
第5版WHO分类提出的胸部SMARCA4-UT
基本诊断标准如下:
①以胸部病变为特征的成人肿瘤;
②组织学表现为弥漫性片状、不同程度粘连的圆形上皮样细胞,细胞核呈泡状,核仁明显;
③无明确上皮分化证据;
④以及通过免疫组化确定的SMARCA4缺失或严重减少。
其他支持性依据:
①免疫组化显示的SMARCA2缺乏;
②CD34、SOX2和SALL4的表达;
③Claudin-4表达缺失或局限。
当临床或形态学怀疑SMARCA4-UT时,例如在有大量吸烟史的男性患者中发现较大的侵袭性胸部肿瘤,或者肿瘤没有清晰的上皮结构或细胞黏附时,应适当地进行SMARCA4的免疫染色。
2. 临床病理特征
(1)临床特点
SMARCA4-UT好发于青年至中年人,年龄范围为27-90岁,平均年龄58岁,中位年龄48岁,大多患者有重度吸烟史,男性为主,种族倾向不明显。累及的部位主要为肺门或肺、纵膈、胸膜及胸壁等胸部部位,肺至少为局部累及。
临床表现主要有:咳嗽、咳痰、呼吸困难、上腔静脉综合征、体重减轻等。部分患者初诊时就已经发现淋巴结转移及胃肠道、腹盆腔等转移症状,也有转移到肝脏、肋骨、肾上腺、颞叶等部位的病例报道。
(2)影像学
SMARCA4-UT典型的影像学常常为边界不清的、体积较大的软组织肿块影,伴有压迫邻近结构症状。
(3)病理学特征
大体观:SMARCA4-UT肿块最大径范围1.5-11cm,平均直径5.1cm,肿物界不清,切面灰白、灰黄,质韧,紧靠脏层胸膜。
镜下观:肿瘤细胞弥漫片状分布,瘤细胞体积大,失粘附,圆形至上皮样,染色质空泡状,核仁明显。细胞核相对单一,偶显示轻至中度多形性。局灶存在横纹肌母细胞样细胞。核分裂象多见,坏死常见。罕见的组织学形态表现包括长梭形细胞、黏液样改变、硬化、肺泡形态和透明细胞改变。大多数病例中缺乏明确的上皮分化证据(如腺体、乳头或角化),但约5%的病例混合有经典的非小细胞肺癌组织学形态。
免疫表型:SMARCA4(BRG1)表达完全缺失或弥漫性显著减弱(25%病例表现为后者);大多数病例SMARCA2(BRM)表达缺失;SMARCB1(INI1)无缺失;多数病例表达CD34、SOX2和/或SALL4;大多数病例p53过表达;细胞角蛋白局灶性或弱表达,也可能完全失表达,但不会呈现弥漫强表达。突触素表达明显(注意鉴别神经内分泌癌);Claudin-4阴性或仅局部阳性;罕见病例可局部表达TTF1、p63、p40或WT1;错配修复蛋白表达完整。
分子遗传学:可检测到SMARCA4基因突变及TP53突变,常伴有KRAS、STK11和/或KEAP1基因突变,高肿瘤突变负荷,个别病例有TSC2、ROS1及ATM突变。
3. 鉴别诊断
鉴于SMARCA4-dNSCLC的形态学多样,在病理诊断中需与以下肿瘤进行鉴别:
(1)淋巴瘤:常有淋巴结无痛进行性肿大;可有B症状;表达淋巴细胞源性的标记;TCR或Ig基因重排阳性。
(2)NUT癌:常发生于中线部位;特征性形态为小细胞背景中出现“突然角化”;可有多量中性粒细胞浸润;表达NUT蛋白;大于75%的病例具有BRD4-NUTM1基因融合。
(3)恶性黑色素瘤:瘤细胞常常失黏附;核偏位类似Rhbodoid样细胞;核仁明显,核呈八字状或豆芽瓣样;表达黑色素标记HMB45,PNL2,MelanA,MiTF等。
(4)CIC重排肉瘤:患者年轻;细胞大小一致,轻度多形,梭形和上皮样,染色质空泡状,核仁明显;胞质嗜酸性,偶尔透明;核分裂象及坏死常见;可有纤维间隔,1/3有黏液样间质。免疫组化标记CD99斑片状阳性;分子检测具有CIC-DUX4基因融合。
(5)上皮样肉瘤:由多边形上皮样细胞和多少不等的梭形细胞组成;免疫组化表达AE1/AE 3,EMA ,CD34;INI表达缺失;95%以上的病例可见SMARCB1基因异常。
(6)SMARCA缺失的非小细胞肺癌:SMARCA4缺失的非小细胞肺癌常常分化更好,常以清晰的腺癌或极少见的鳞状细胞癌形态出现。腺癌通常以实体型为主,包含多种分化形态(腺泡、黏液、乳头状、印戒细胞样),瘤细胞常表现为透明细胞,局部可见横纹肌样肿瘤细胞或肉瘤样区域;很少显示BRM缺失(~30%),几乎总是claudin-4阳性(>95%),CK7弥漫表达,CD34通常为阴性。仅在10~15%的病例中观察到SOX2和SALL4的局灶性表达。
(7)低分化神经内分泌癌(NEC):NEC分化差时需要鉴别,NEC除了表达上皮标记物外还表达神经内分泌标记物(如CgA,CD56,SYN及INSM1),可见到P53突变表达和RB蛋白的缺失表达,SMARCA4蛋白几乎无缺失表达即核阳性,以上各点可以与SMARCA4-UT和SMARCA4-dNSCLC相鉴别。
(8)上皮样间皮瘤:部分上皮样间皮瘤中也可以见到SMARCA4核缺失表达,但形态学上多以乳头状、腺样为主,且表达间皮肿瘤标记物(如MC、D2-40、CR、WT-1及CK5/6),以上可以与SMARCA4-UT和SMARCA4-dNSCLC相鉴别。
(9)其他SWI/SNF复合体缺失的肿瘤转移到肺或胸膜:由于肺是全身多种肿瘤的常见转移部位,且SMARCA4缺失型肿瘤可见于全身各器官,因此在诊断时综合考虑临床、影像及免疫组化结果和患者病史进一步排除其他部位的转移性肿瘤如妇科、鼻咽部、消化道等。
4.治疗及预后
目前SMARCA4- UT尚无标准治疗方案。早期或局部晚期患者可能从根治性手术和辅助化疗(或同时联合贝伐珠单抗)中获益。近年来,新的靶向治疗和表观遗传调控因子包括CDK4/6抑制剂、OXPHOS抑制剂、BETi、AURKA抑制剂、PARP抑制剂和ATR抑制剂不断涌现。效果有待大量临床数据验证。 未来的研究需要更深入地探索TSDUT的发病机制、生物学行为和分子特征,以寻找更有效的治疗方法,改善TSDUT患者的预后。
参考文献:
[1] Li X, Tian S, Shi H, et al.The golden key to open mystery boxes of SMARCA4-deficient undifferentiated thoracic tumor: focusing immunotherapy, tumor microenvironment and epigenetic regulation[J].Cancer Gene Therapy, 2024, 31(5):687-697.DOI:10.1038/s41417-024-00732-4.
[2] Yuki S, Yuichiro O, the Lung Cancer Study Group of the Japan Clinical Oncology Group JCOG.Thoracic SMARCA4-deficient undifferentiated tumor: current knowledge and future perspectives[J].Japanese Journal of Clinical Oncology, 2023(3):3.DOI:10.1093/jjco/hyad175.
[3] Kezlarian B, Montecalvo J, Bodd F M, et al.Diagnosis of thoracic SMARCA4-deficient undifferentiated tumor in cytology[J].Cancer cytopathology. 2023.
[4] Jiang, J., Chen, Z., Gong, J. et al. Thoracic SMARCA4-deficient undifferentiated tumor. Discov Onc 14, 51 (2023).
[5] WHO Classification of Tumours Editorial Board. WHO classification of tumours. Thoracic Tumours[M]. 5th ed. Lyon: IARC Press, 2021.
[6] 李 媛,谢惠康,武春燕. WHO胸部肿瘤分类(第5版)中肺肿瘤部分解读[J]. 中国癌症杂志, 2021, 31 (7): 574-580.
[7] Liang X, Gao X, Wang F, Li S, Zhou Y, Guo P, Meng Y, Lu T: Clinical characteristics and prognostic analysis of SMARCA4-deficient non-small cell lung cancer. Cancer medicine 2023, 12(13):14171-14182.
[8]Nambirajan A, Singh V, Bhardwaj N, Mittal S, Kumar S, Jain D: SMARCA4/BRG1-Deficient Non-Small Cell Lung Carcinomas: A Case Series and Review of the Literature. Archives of pathology & laboratory medicine 2021, 145(1):90-98.
[9]Schoenfeld AJ, Bandlamudi C, Lavery JA, Montecalvo J, Namakydoust A, Rizvi H, Egger J, Concepcion CP, Paul S, Arcila ME et al: The Genomic Landscape of SMARCA4 Alterations and Associations with Outcomes in Patients with Lung Cancer. Clinical cancer research : an official journal of the American Association for Cancer Research 2020, 26(21):5701-5708.
[10] Shinno Y, Yoshida A, Masuda K, Matsumoto Y, Okuma Y, Yoshida T, Goto Y, Horinouchi H, Yamamoto N, Yatabe Y et al: Efficacy of Immune Checkpoint Inhibitors in SMARCA4-Deficient Thoracic Tumor. Clinical lung cancer 2022, 23(5):386-392
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言
















#病理诊断# #SMARCA4#
26 举报