【衡道丨病例】病理诊断——乳腺具有髓样特征的浸润性癌
2025-07-16 衡道病理 衡道病理 发表于上海
本期,williamhill asia 将通过1例病例为大家详解乳腺具有髓样特征的浸润性癌的病理诊断知识。
病史介绍
女性,39岁,因“发现右乳包块4天”入院。
辅助检查
乳腺(双侧)对比增强能谱X线成像(图1):
双侧乳腺呈c型,重度背景强化,腺体分布欠均匀,部分腺体聚集并密度增高,右乳外上象限见簇状分布少许点状钙化灶,背景强化明显,掩盖此区域,左乳内未见肿块、未见恶性钙化及异常血管征象。 影像意见:双侧乳腺增生症(BI-RADS 2类)。右乳外上象限钙化灶(BI-RADS 0类),背景强化明显(经前期),建议:经净后复查。
入院当日在局麻下行“(右侧)乳房病损切除术”。
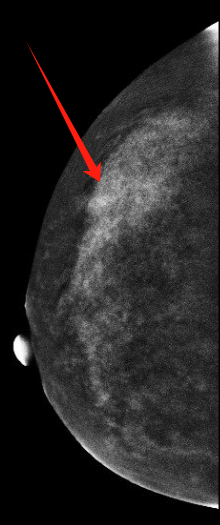
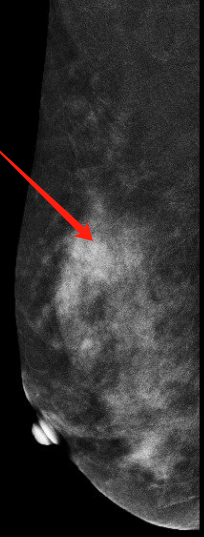
图1 乳腺对比增强能谱X线成像:右乳外上象限见簇状分布少许点状钙化灶,背景强化明显。(左:RCC头尾位,右:RMLO外侧斜位)
组织病理活检
1、大体肉眼观:
灰白灰黄组织一堆,20*15*7mm。
2、镜下观(图2-图8):
低倍镜下肿瘤呈膨胀性生长,边界清楚,挤压周围组织可见推挤性边缘,癌细胞排列呈巢状或实性片状;中倍镜下,癌细胞排列呈实性片状,间质弥漫淋巴细胞、浆细胞浸润,肿瘤内缺乏腺管结构,部分区中央可见坏死;高倍镜下,细胞合体样,实性片状分布,核分裂象易见;肿瘤细胞呈泡状核,核仁明显,部分胞浆嗜酸性。
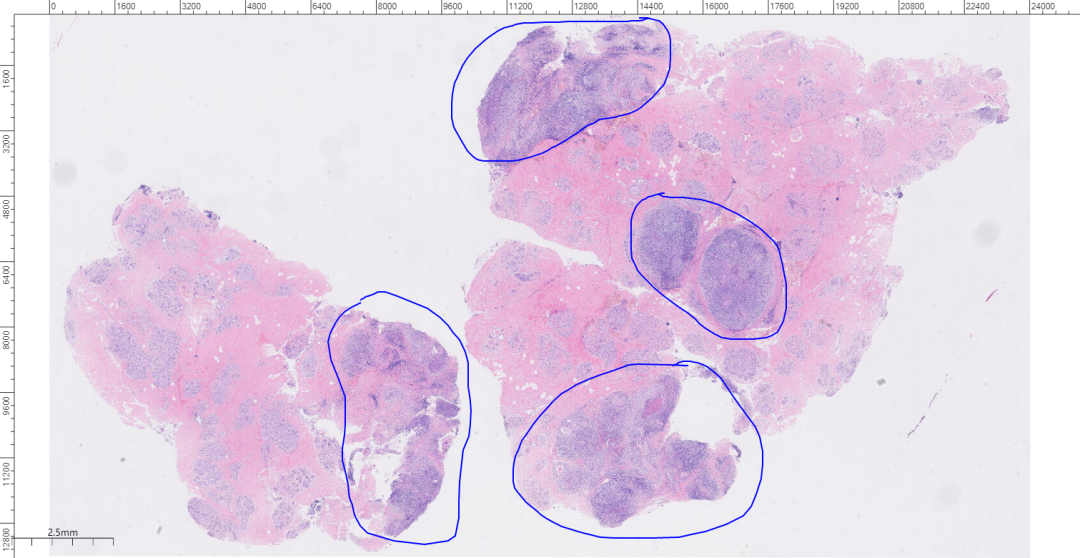
图2 低倍镜下肿瘤呈多灶分布,边界清楚。
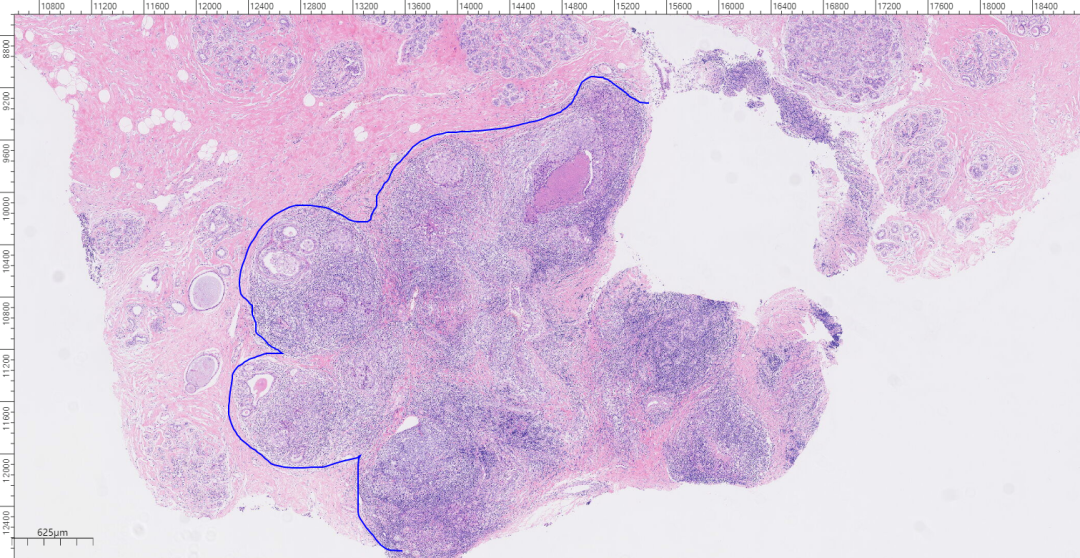
图3 低倍镜下,肿瘤呈膨胀性生长,挤压周围组织可见推挤性边缘。
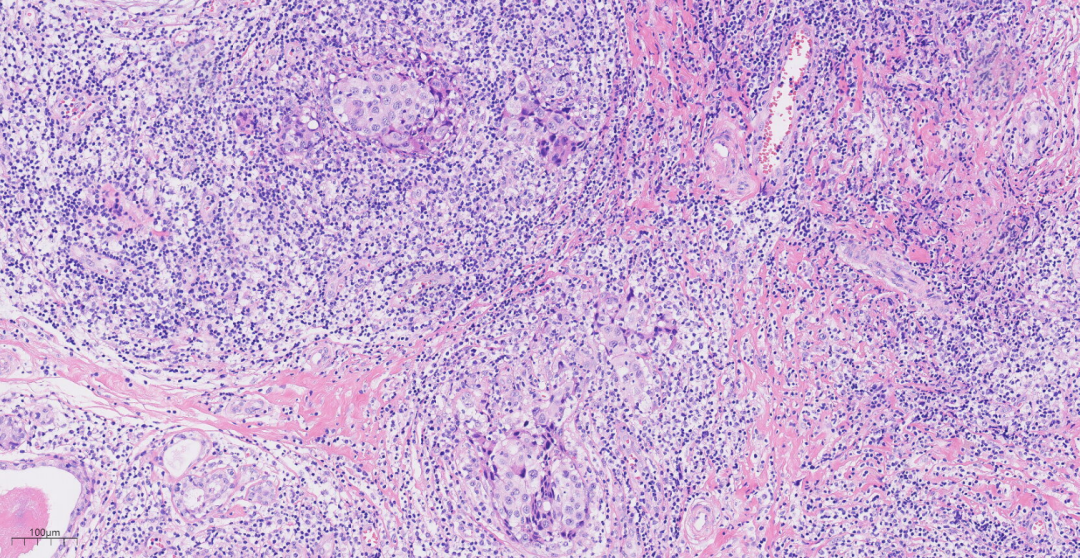
图4 中倍镜下,癌细胞排列呈实性片状,间质弥漫淋巴细胞、浆细胞浸润。
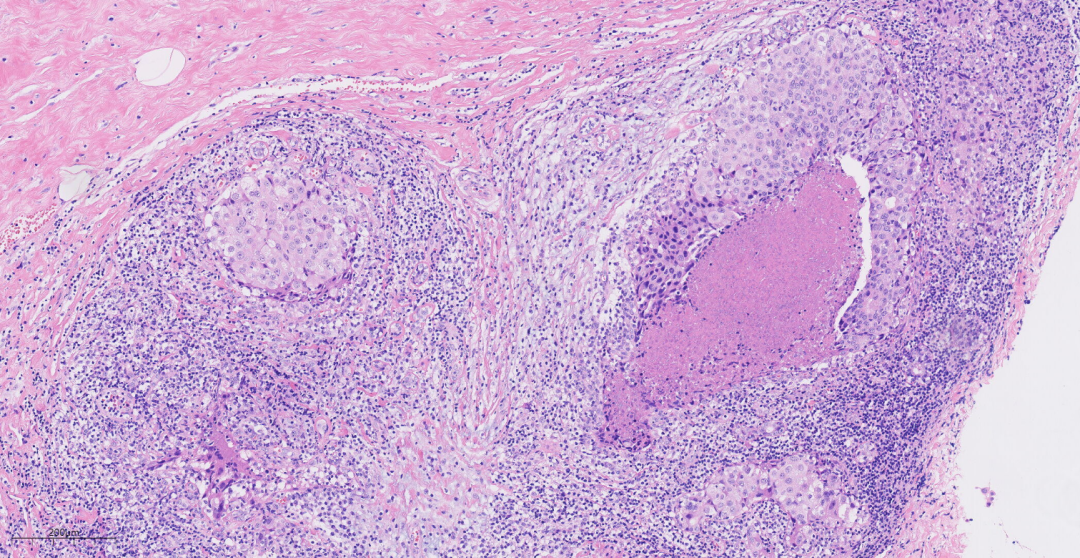
图5 肿瘤内缺乏腺管结构,部分区中央可见坏死。
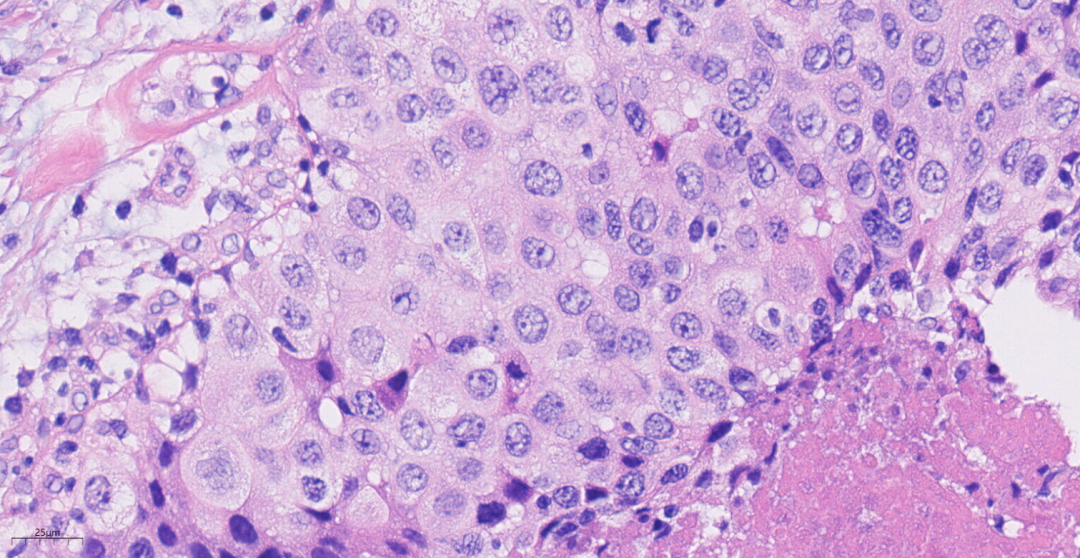
图6 高倍镜下,肿瘤细胞合体样,实性片状分布,核分裂象可见。
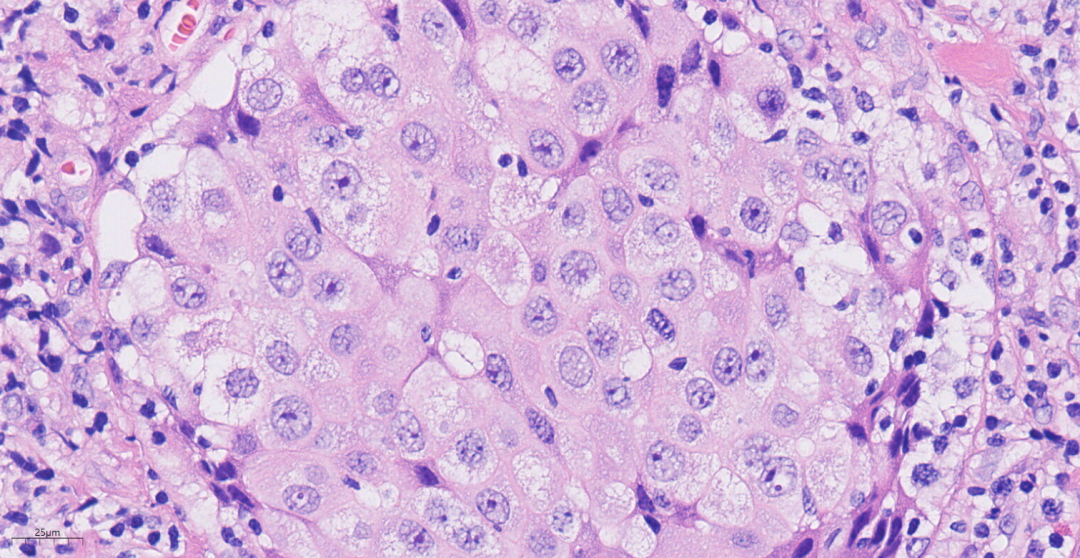
图7 高倍镜下,肿瘤细胞呈泡状核,核仁明显。
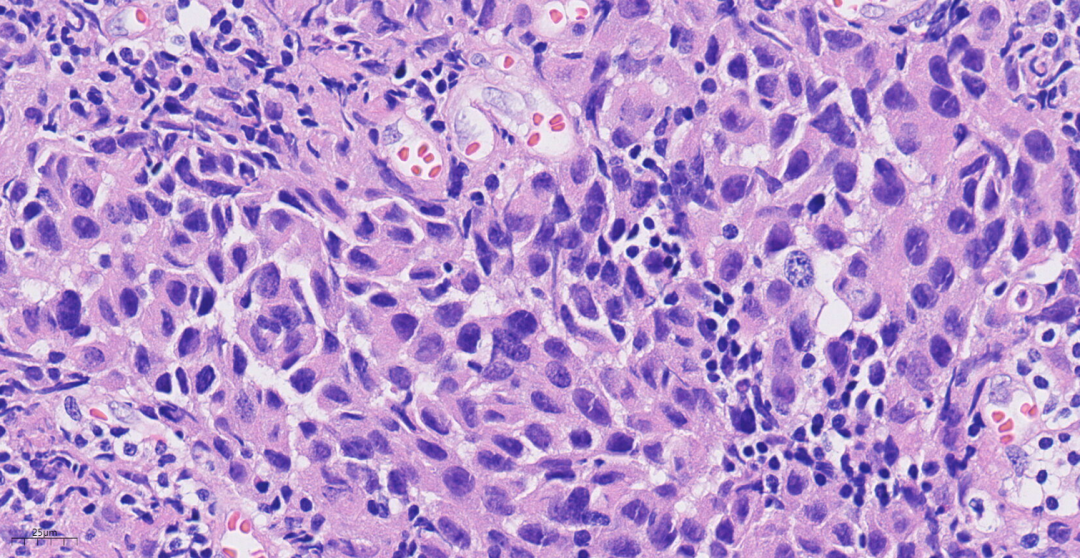
图8 部分肿瘤细胞胞浆嗜酸性。
3、免疫组化(图9-图15):
免疫组化示肿瘤细胞:
CK(+++),E-cadherin(+++),P120(膜+++),GATA3(+++),GCDFP-15(偶见+/-),CK5/6(-),p63(-);浸润性癌成分ER(-),PR(-),HER2(3+),Ki-67(约30%+),结合CK5/6、p63标记结果提示肿瘤实质内肌上皮细胞缺失;原位癌成分ER(-),PR(-),HER2(3+),Ki-67(约30%+),结合CK5/6、p63标记结果提示肿瘤实质内肌上皮细胞存在。
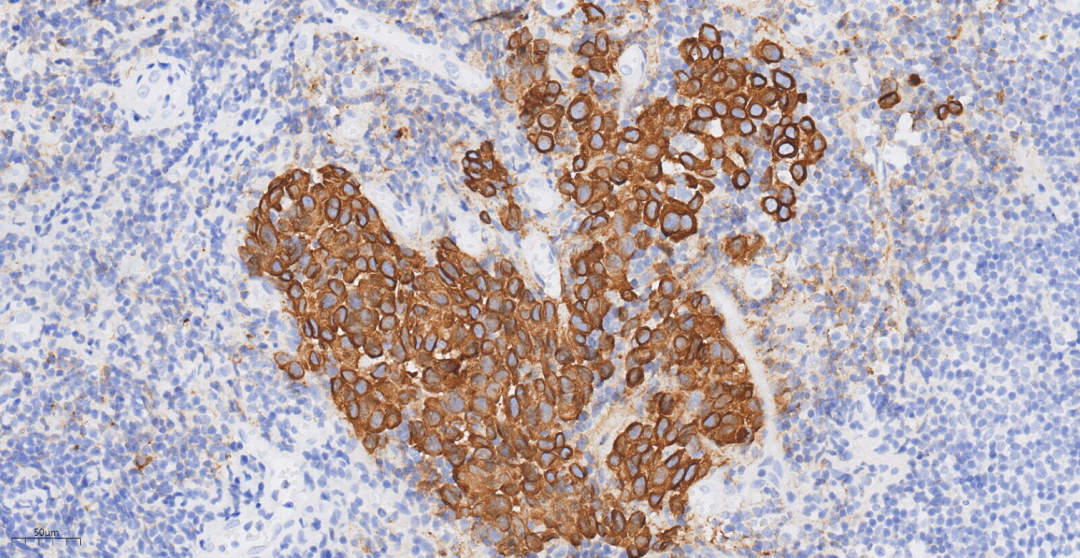
图9 免疫组化示肿瘤细胞CK(+++)
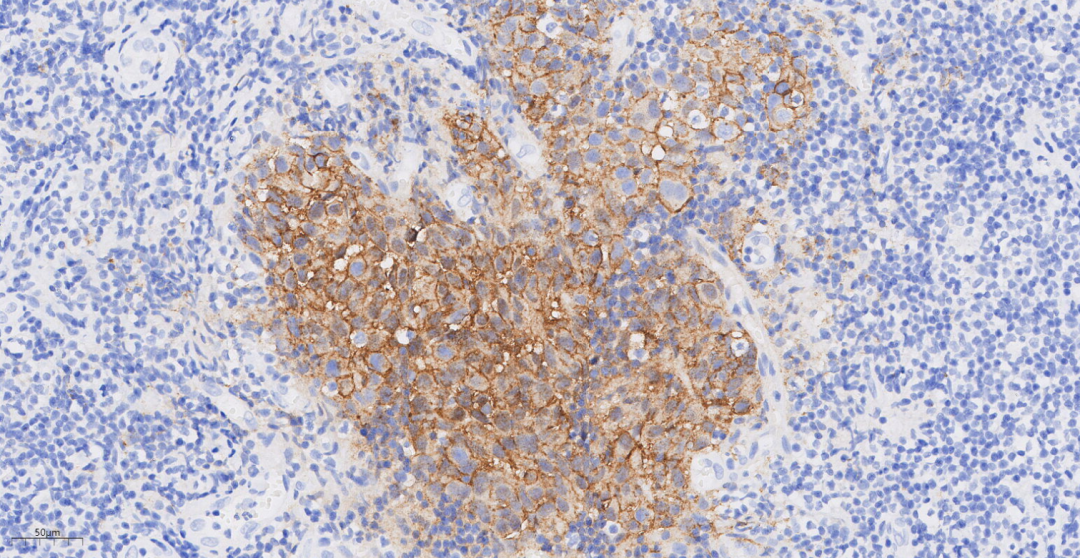
图10 免疫组化示肿瘤细胞E-cadherin(+++)
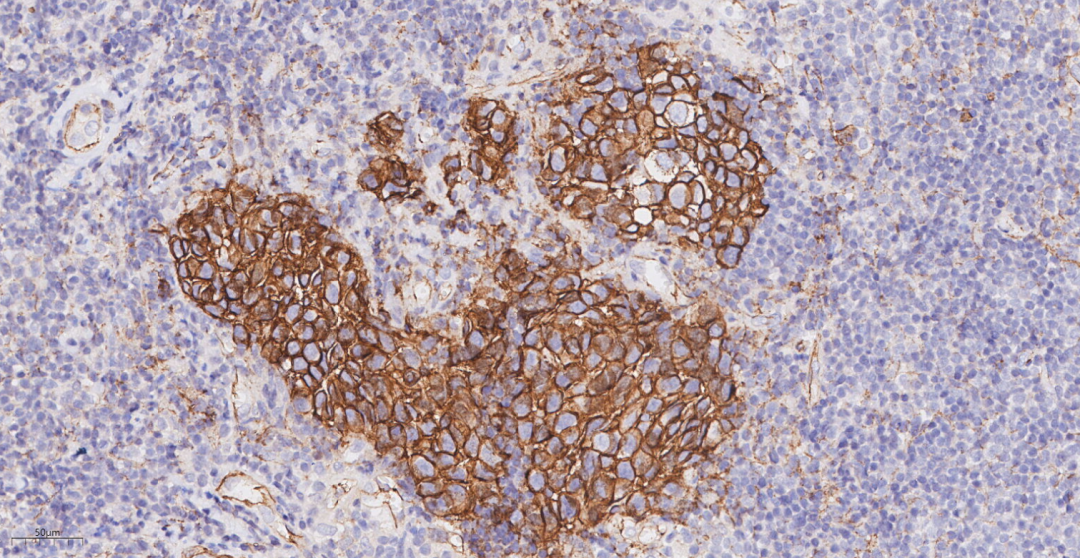
图11 免疫组化示肿瘤细胞P120(膜+++)
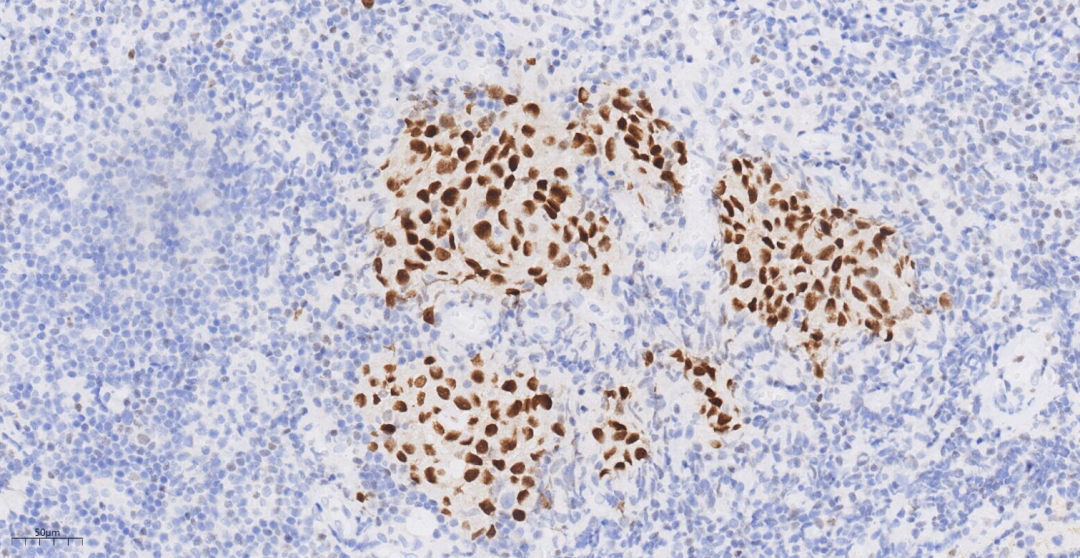
图12 免疫组化示肿瘤细胞GATA3(+++)
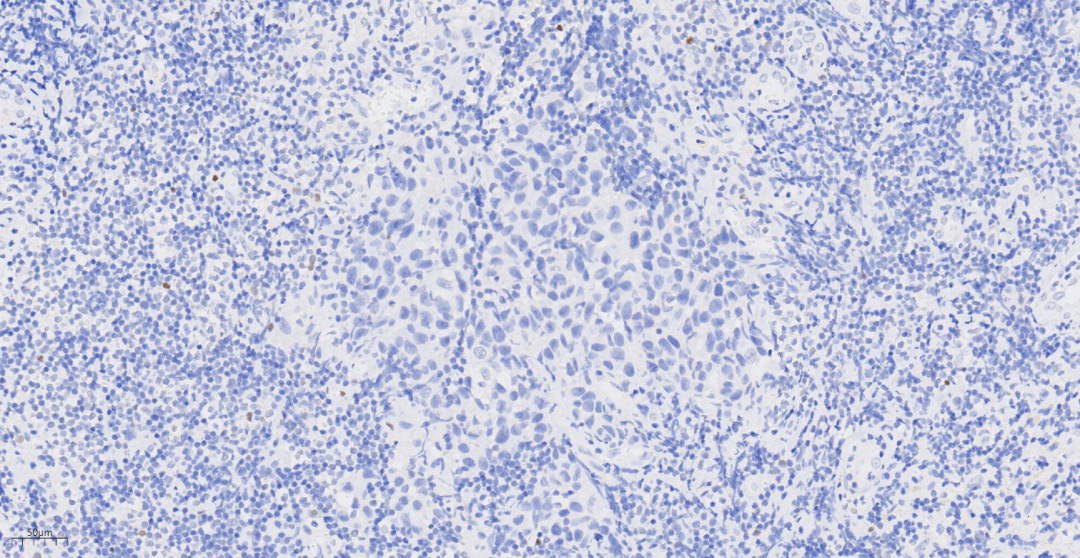
图13 免疫组化示p63提示浸润性癌成分肌上皮细胞缺失
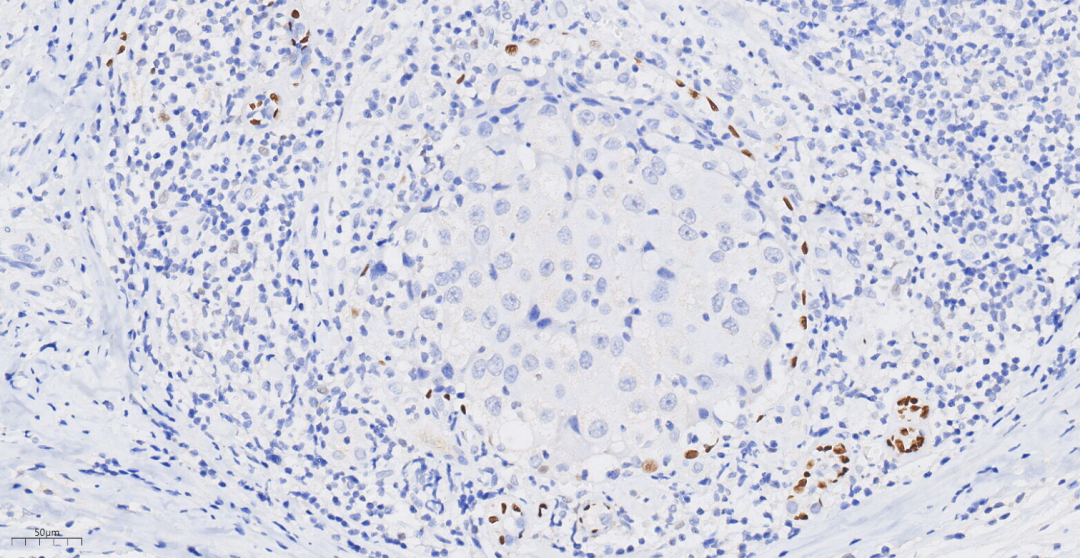
图14 免疫组化示p63提示原位癌成分肌上皮细胞存在
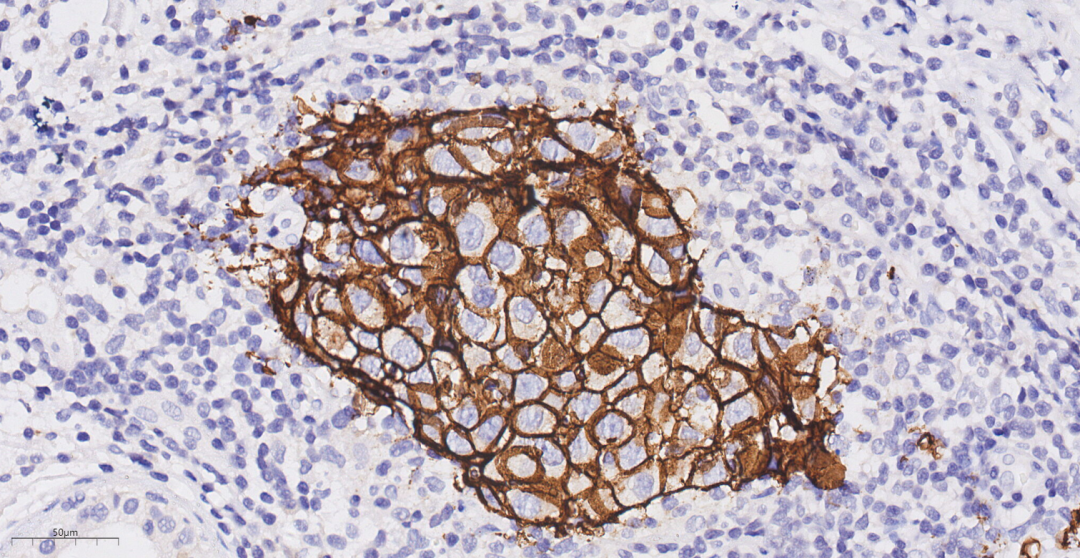
图15 免疫组化示浸润性癌HER2(3+)
病理诊断
(右侧)乳腺具有髓样特征的浸润性癌,伴中-高级别导管原位癌。
讨论
1、背景
乳腺髓样癌(medullary breast carcinoma, MBC)是一种较为少见的乳腺癌组织学亚型,发病例数约占所有乳腺癌的1%~5%,具有独特的病理学特征和预后,MBC一般具有边界清楚或具有推挤性边界、合体细胞样生长方式,具有高级别异型的细胞核,伴有显著的淋巴组织浸润。
经典型髓样癌罕见,不足全部乳腺癌的1%,但由于诊断标准的严格性不同,也有较高的比例被报道。患病率较高的研究中有可能包含非典型髓样癌和/或伴髓样特征的非特殊型浸润性癌的病例,实际应用这些诊断标准存在困难,导致不同观察者间诊断的重复性差,且与基底样分子谱系的癌和BRCA1突变相关的癌的特征有重叠。因此,2019年版WHO乳腺肿瘤组织学分类中,将髓样癌、非典型髓样癌和具有髓样癌特征的非特殊类型浸润性癌笼统划为一组肿瘤,称为伴髓样特征的癌。
此外,也有学者认为高级别乳腺癌不符合严格髓样标准的高级别癌中TILs在解释其预后好方面的预后重要性日益得到肯定,减少了对这些形态具有一定连续性的肿瘤的进一步区分的必要性;因此,出于临床目的,建议将具有髓样特征的癌视为富于TILs的IBCNSTs谱系的一端,而不是一个独特的形态学亚型,并使用“具有髓样结构的IBC-NST”术语。
2、MBC的临床病理特征
(1)临床特点
MBC常见于年轻女性,35-65岁,以肿块为主要表现,肿块界清,质偏软,其临床表现和触诊与纤维腺瘤等良性肿瘤相似。
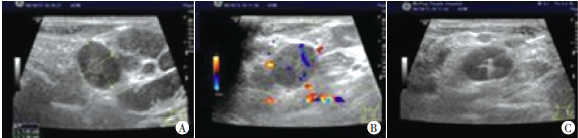
(2)影像学
超声多表现为低或极低回声、纵横比小于1、少钙化、少囊变、血流丰富、高血流阻力指数、后缘回声增强、淋巴结转移少见。MRI上,MBC均呈T2WI高信号,病灶强化特征为不均匀强化,DWI呈高信号,同时MBC病灶可因血流供应不足出现肿瘤内囊变或坏死。
(3)病理学特征
肉眼观:
大体上,MBC通常边界清楚, 质软到质中,平均直径2.5~2.9cm, 似纤维腺瘤,部分呈多结节状,可伴有出血、坏死或囊性变。
镜下观:
组织形态学上,2019年《WHO 乳腺肿瘤组织学分类》(第5版)诊断标准:
(1)合体细胞结构占肿瘤组织≥75%;
(2)全部肿瘤组织不具有腺样或管状结构(实性癌);
(3)间质中弥漫的淋巴细胞、浆细胞浸润为其显著特点;
(4)癌细胞多呈圆形,胞质丰富,泡状核,核异型明显,呈2、3级,核分裂象多见;
(5)低倍镜下,肿瘤组织边界清楚,呈推挤状,肿瘤外周有纤维带。
当肿瘤满足有明显的合体细胞特征,但未满足所有上述5项标准,仅具有其中2项或3项标准时通常被诊断为非典型髓样癌。
并提出将髓样癌、不典型髓样癌、伴有髓样特征的浸润性癌都归在浸润性癌下,统称为伴有髓样特征的浸润性癌,又名伴髓样或肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes, TIL)丰富的浸润性乳腺癌的非特殊类型(invasive breast cancer of non-specific types,IBC-NST)。
少数病例可见奇异型多核巨细胞,可有鳞状细胞、梭形细胞、骨或软骨化生。
免疫表型:
根据传统观念,MBC通常ER、PR及HER-2阴性 (“三阴性乳腺癌”),但随着报道病例数增加,不同机构研究表明ER/PR阳性表达率从19%~32%不等,HER-2阳性表达率从10.64%~25.0%不等,部分可表达基底细胞相关蛋白:CK5/6、CK14、EGFR、SOX10等。p63、SMA、SMMHC、Calponin、CD10示浸润性癌成分肌上皮缺失。
分子遗传学特征:
MBC通常具有BRCA1基因,p53基因突变。
3. 鉴别诊断
MBC主要应与以下肿瘤相鉴别:
(1)乳腺原发淋巴上皮瘤样癌(LELC):
MBC临床上较为常见,MBC肿瘤细胞呈圆形或卵圆形,细胞异型性明显,间质有丰富的淋巴细胞及浆细胞浸润,故经常被误诊,典型乳腺髓样癌呈合体细胞样生长的肿瘤细胞成分通常在75%以上,肿瘤细胞异型性更明显,高级别胞核,核分裂象多见,缺乏腺管结构,具有膨胀性或推挤性边缘,境界清楚,缺乏对周围乳腺及脂肪组织的浸润性生长现象。需注意的是非典型髓样癌,如肿瘤出现浸润性边缘,肿瘤细胞异型性小,核分裂较少,而淋巴浆细胞减少并出现胶原硬化性间质和明显腺管状或乳头状结构时,仅凭组织形态学与乳腺LELC鉴别诊断具有一定挑战性。MBC与LELC相似,富于淋巴间质,且免疫表型多表现为三阴性,两者均与EBV病毒感染无关,但LELC肿瘤无明显包膜,切面多呈灰白色,质硬,与周围乳腺组织界限不清,呈浸润性生长,很少有合体样细胞生长方式,有助于鉴别诊断。
(2)富于淋巴细胞的浸润性导管癌及小叶癌:
部分浸润性导管癌及小叶癌间质内有多少不等淋巴细胞浸润,偶见大量淋巴细胞浸润,甚至淋巴滤泡形成,但多不如MBC弥漫,且具有浸润性导管癌或小叶癌典型结构和细胞学特征,间质硬化明显。与MBC相比,浸润性乳腺癌肿瘤界限不清,呈弥漫性浸润性生长,通常缺乏合体细胞生长方式。
(3)富于淋巴细胞的导管原位癌及小叶原位癌:
MBC常呈结节状,部分肿瘤细胞岛类结构类似导管原位癌或小叶原位癌,可行免疫组化标记肌上皮以资鉴别。
(4)化生性癌:
化生性癌平均年龄较MBC大,其特征为肿瘤性上皮向鳞状细胞和/或间叶成分分化,可以形成梭形细胞、软骨细胞、骨细胞和横纹肌细胞。肿瘤可完全由化生的成分构成,也可以由癌和化生的区域混合构成,>90%的化生性癌ER、PR及HER-2阴性,高分子量角蛋白34βE12、CK5/6、CK14及AE1/AE3阳性;低分子量角蛋白通常阴性,超过90%的化生性乳腺癌表达p63。
(5)淋巴瘤或髓样癌合并淋巴瘤:
MBC中含有显著的淋巴浆细胞浸润,如果局部肿瘤细胞呈弥漫状浸润,则容易与淋巴瘤混淆,但免疫组化MBC表达CK,而淋巴瘤表达淋巴造血系统肿瘤标志物(LCA,CD20,CD79a,CD3,CD5等)。当髓样癌间质淋巴细胞异常增生时,亦不能除外髓样癌合并淋巴瘤可能性,免疫表型及分子检测有助于鉴别。
(6)大细胞神经内分泌癌:
肿瘤细胞致密分布,排列呈实性巢状、小梁状,细胞形态从梭形到浆细胞样或透明大细胞样,由纤细的纤维血管间质隔开。免疫组化标记显示CD56、CgA、Syn、NSE呈不同程度的阳性。
(7)乳腺炎症:
如硬化性淋巴细胞小叶炎,表现为以小叶为中心的小叶内外大量淋巴细胞浸润;低倍镜下呈结节状,小叶内腺管上皮可出现不典型性增生,少数MBC具有淋巴细胞小叶炎背景,但两者鉴别并不困难,淋巴细胞小叶炎有小叶轮廓,周围有硬化带,淋巴浆细胞围绕小血管周围,缺乏具有泡状核的恶性上皮细胞。
(8)乳腺原发经典型结节硬化型霍奇金淋巴瘤:
临床上极其罕见,病变多累及腋下淋巴结和乳腺组织,或全身多发霍奇金淋巴瘤累及乳腺。该肿瘤表现为结节状密集淋巴细胞被纤维性条带分隔,并形成结节状构型,间质常见嗜酸性粒细胞、组织细胞及嗜中性粒细胞等浸润。而MBC也可出现少量R-S样细胞,一般不出现霍奇金淋巴瘤中的各种炎症细胞。区别两者有效的方法是广泛取材,全面仔细观察,如发现小叶不典型增生或原位癌则支持癌诊断。免疫组化标记淋巴瘤肿瘤细胞常表达CD30、CD15和Pax-5而上皮标记物常呈阴性;而LELC肿瘤细胞免疫表型则与之相反。
(9)转移性癌:
乳腺转移性肿瘤大多形成境界清楚的多结节,一般多为肿瘤晚期患者,多为肺癌、卵巢癌,肾癌、胃癌等肿瘤转移,临床病史及免疫组化可以帮助鉴别。
4.治疗及预后
目前并没有针对乳腺有髓样特征的浸润性癌的独特的治疗靶点或药物。其治疗参照非特殊浸润性乳腺癌的治疗方案,以手术为主,放射治疗、化疗、内分泌治疗和靶向治疗为辅的综合治疗策略。通常认为,激素受体阴性、高组织学分级及抑癌基因突变往往提示MBC预后不良,但实际情况却恰恰相反,多个研究发现其预后好于浸润性导管癌。MBC发病年龄与浸润性导管癌相比较小,其生物学行为与病理特征不相符:肿瘤体积较小、较少发生淋巴结转移尽管其组织学分级较高、激素受体多为阴性、基底细胞样型等特点,但其预后相对较好,10年总生存率可达到90%左右。
参考文献:
[1]谭巧,苏小涵,侯令密,等.乳腺髓样癌临床病理特征、治疗及预后的分析[J].现代肿瘤医学,2024,32(15):2767-2776.
[2]杭永平,刘宏斌.乳腺髓样癌5例病理分析[J].江苏医药,2018,44(12):1484-1485+1502.DOI:10.19460/j.cnki.0253-3685.2018.12.043
[3]涂建国.磁共振成像在纤维腺瘤与乳腺髓样癌鉴别诊断中的应用[J].实用医技杂志,2020,27(11):1454-1456.DOI:10.19522/j.cnki.1671-5098.2020.11.010.
[4]朱亚金,董华,毛春桃,等.彩色多普勒超声鉴别诊断乳腺髓样癌、乳腺纤维瘤的实际效果观察[J].中国医疗器械信息,2023,29(15):79-81.DOI:10.15971/j.cnki.cmdi.2023.15.022
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言



















#乳腺# #浸润性癌#
1 举报