Cell Stem Cell | HBO1 在肝损伤期间作为肝细胞可塑性和重编程的表观遗传屏障发挥作用
2025-05-27 MedSci原创 MedSci原创 发表于上海
本研究揭示了HBO1在肝细胞向胆管细胞重编程中的关键作用。HBO1通过调控H3K14ac和招募ZMYND8蛋白,抑制YAP/TEAD的转录功能,从而限制肝细胞的可塑性。
肝脏损伤后,肝细胞(hepatocytes)具有重新编程为胆管上皮细胞(biliary epithelial cells, BECs)的能力,这一过程对于肝脏的再生和修复至关重要。然而,目前对于这一过程背后的表观遗传调控机制仍知之甚少。表观遗传学研究揭示了基因表达调控的复杂性,特别是在细胞命运决定和细胞可塑性方面。近年来,YAP/TEAD信号通路在肝细胞重编程中的作用逐渐受到关注。YAP(Yes1-Associated Protein)是Hippo信号通路的关键转录共激活因子,其激活能够诱导肝细胞向胆管细胞命运转变。然而,YAP如何通过表观遗传机制调控这一过程,以及是否存在表观遗传障碍限制了肝细胞的可塑性,这些问题仍有待解答。
近日,国际权威期刊《Cell Stem Cell》杂志上在线发表了题为“HBO1 functions as an epigenetic barrier to hepatocyte plasticity and reprogramming during liver injury”的研究中,利用单细胞染色质可及性分析(scATAC-seq)和体内CRISPR筛选技术,揭示了肝细胞向胆管上皮细胞重编程过程中的表观遗传动态变化。研究发现,YAP/TEAD的激活是染色质重塑的关键驱动因素,而组蛋白乙酰转移酶HBO1则是这一重编程过程的主要障碍。HBO1通过促进组蛋白H3第14位赖氨酸的乙酰化(H3K14ac),招募ZMYND8蛋白,抑制YAP/TEAD的转录功能。通过靶向HBO1,可以增强肝细胞的可塑性,加速肝细胞向胆管细胞的转化,为胆管疾病的治疗提供了潜在的新策略。

研究者首先利用3,5-二乙氧基羰基-1,4-二羟基胆碱(DDC)饮食模型诱导肝细胞向胆管细胞转化,并通过单细胞ATAC-seq技术分析了这一过程中的染色质可及性变化。结果显示,与正常肝细胞相比,重编程后的细胞在染色质可及性上与胆管细胞更为相似,表明染色质状态在细胞命运转变过程中发生了显著的重塑。进一步的转录因子(TF)motif分析发现,YAP/TEAD信号通路的激活与染色质可及性的增加密切相关,提示YAP在肝细胞重编程中发挥关键作用。
为了进一步验证YAP在肝细胞重编程中的作用,研究者构建了YAP过表达的小鼠模型。通过单细胞染色质可及性分析,发现YAP激活后,肝细胞的染色质可及性迅速发生变化,尤其是在YAP靶基因和胆管细胞特异性基因的调控区域。然而,即使在YAP激活28天后,重编程的肝细胞仍保留部分肝细胞染色质特征,这表明YAP介导的重编程是一个渐进且不完全的过程。
研究者进一步利用CRISPR-Cas9技术进行体内筛选,以鉴定参与YAP介导重编程的表观遗传调控因子。通过构建包含sgRNA的文库,并将其导入小鼠肝脏,研究者发现HBO1是YAP介导重编程的主要障碍。HBO1的缺失显著加速了肝细胞向胆管细胞的转化,并增强了YAP靶基因的表达。
HBO1是一种组蛋白乙酰转移酶,能够催化组蛋白H3第14位赖氨酸的乙酰化(H3K14ac)。研究发现,HBO1通过促进H3K14ac,招募ZMYND8蛋白,进而抑制YAP/TEAD的转录功能。在HBO1缺失的情况下,YAP和TEAD4在靶基因上的结合增加,导致染色质可及性增强,从而促进肝细胞向胆管细胞的转化。
研究者进一步在DDC诱导的肝损伤模型和4,4′-亚甲基二苯胺(MDA)诱导的胆管损伤模型中验证了HBO1的功能。结果表明,HBO1的缺失显著增强了肝细胞向胆管细胞的转化能力,并促进了胆管细胞的再生。此外,HBO1的缺失还导致YAP靶基因和胆管细胞特异性基因的表达增加,进一步证实了HBO1在限制肝细胞可塑性中的作用。
综上所述,本研究揭示了HBO1在肝细胞向胆管细胞重编程中的关键作用。HBO1通过调控H3K14ac和招募ZMYND8蛋白,抑制YAP/TEAD的转录功能,从而限制肝细胞的可塑性。这一发现不仅为理解肝细胞重编程的表观遗传调控机制提供了新的视角,还为开发针对胆管疾病的新型治疗策略提供了潜在的靶点。通过靶向HBO1,有望增强肝细胞的可塑性,促进胆管细胞的再生,为肝脏疾病的治疗带来新的希望。
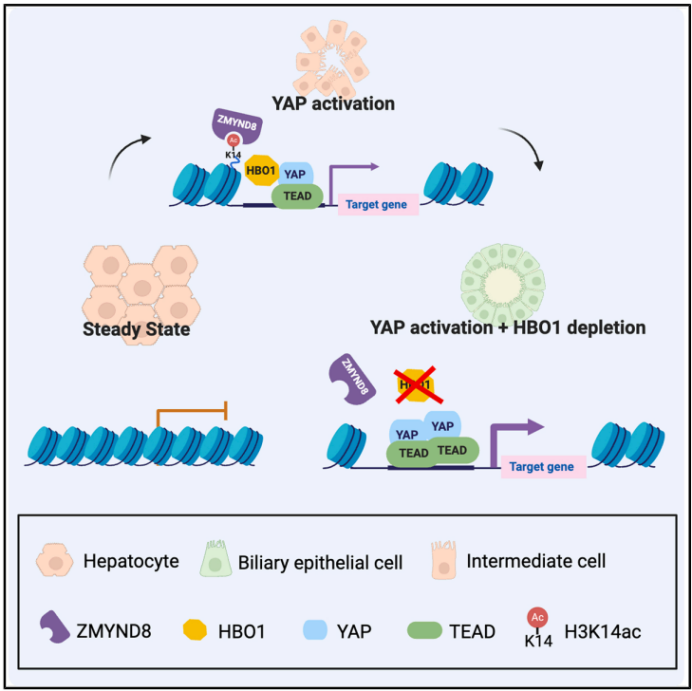
图 本研究模式图
原始出处:
HBO1 functions as an epigenetic barrier to hepatocyte plasticity and reprogramming during liver injury. Cell Stem Cell. 2025 May 19:S1934-5909(25)00177-8. doi: 10.1016/j.stem.2025.04.010. Epub ahead of print. PMID: 40403721.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言














#肝损伤# #表观遗传# #重编程#
28 举报