【论著】|TACE联合安罗替尼及信迪利单抗治疗CNLC Ⅱb~Ⅲb期肝癌患者的疗效及安全性评估
8小时前 中国癌症杂志 中国癌症杂志 发表于上海
本研究计划在靶免联合治疗的基础上加入TACE治疗,旨在评估TACE联合安罗替尼及信迪利单抗治疗CNLC Ⅱb~Ⅲb期肝癌的近期疗效及安全性。
[摘要]背景与目的:中国是一个肝癌高发病率和高死亡率的国家。2022年,中国肝癌发病人数约36.8万例,死亡人数约31.7万例。如何延长肝癌患者的生存期是亟待解决的问题。近年来,酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)单独或联合免疫检查点抑制剂用于原发性肝癌的治疗获得不错的效果。然而多数研究没有联合经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)治疗。williamhill asia 猜想在TKI药物联合免疫检查点抑制剂的基础上再联合TACE治疗有可能使肝癌患者获益更大。因此,本研究旨在评估TACE联合安罗替尼和信迪利单抗治疗肝癌的近期疗效及安全性。方法:本研究是一项单臂Ⅱ期临床试验,已通过宜宾市第三人民医院伦理委员会的审查(伦理批号:2022009)。纳入标准:① 年龄18~70岁;② 经临床诊断或组织学检查证实的原发性肝癌;③ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~1分;④ 中国肝癌的分期方案(China Liver Cancer Staging,CNLC)Ⅱb~Ⅲb期;⑤ 心肺功能良好;⑥ Child-Pugh分级为8分及以下;⑦ 至少有1个可以通过改进的实体瘤疗效评价标准(modified Response Evaluation Criteria in Solid Tumors,mRECIST)1.1测量的肿瘤病灶。2021年11月1日—2024年3月1日,共纳入61例患者,符合条件者39例。首先对所有入组患者进行TACE治疗。初次TACE术后1周左右予以口服安罗替尼12 mg(根据耐受情况调整用药剂量),第1~14天,每3周1次;同时予以静脉注射信迪利单抗200 mg,第1天,每3周1次。每完成2个周期治疗后根据mRECIST1.1进行疗效评估。研究的主要观察指标为客观缓解率(objective response rate,ORR),次要观察指标为中位无进展生存期(median progression-free survival,mPFS)、疾病控制率(disease control rate,DCR)及安全性。结果:ORR为76.9%,DCR为94.9%,mPFS为9.2个月(95% CI:2.317~16.083)。39例(100%)发生1~2级不良反应,15例(38.5%)发生3级不良反应,5例(12.8%)发生4级不良反应,1例患者因上消化道出血死亡。在以TACE联合靶免治疗为主的阶段中,3~4级不良反应的发生率要高于安罗替尼联合信迪利单抗为主的治疗阶段。绝大多数不良反应通过常规治疗手段可缓解。结论:TACE联合安罗替尼及信迪利单抗治疗CNLC Ⅱb~Ⅲb期肝癌的疗效确切,总体安全可控。这种联合治疗或将为CNLC Ⅱb~Ⅲb期肝癌患者提供新的治疗模式。但这种治疗模式下所引起的疼痛、呕吐、食欲减退、肝功能损伤、上消化道出血等问题需要进一步探索其解决方案。
[关键词] 肝癌;经导管动脉化疗栓塞术;信迪利单抗;安罗替尼;靶免联合治疗
[Abstract] Background and purpose: China is a country with high incidence rate and mortality of liver cancer. In 2022, there were approximately 368 000 cases of liver cancer and 317 000 deaths in China. Extending the survival period of liver cancer patients is an urgent issue that we need to address. In recent years, tyrosine kinase inhibitor (TKI) alone or in combination with immune checkpoint inhibitors have achieved good results in the treatment of primary liver cancer. However, most studies did not include the combination of transcatheter arterial chemoembolization (TACE) treatment. We speculate that combining TKI drugs with immune checkpoint inhibitors and TACE therapy may provide greater benefits to liver cancer patients. Therefore, this study aimed to evaluate the short-term efficacy and safety of TACE combined with anlotinib and sintilimab in the treatment of liver cancer. Methods: This study is a single arm phase Ⅱ clinical trial approved by the ethics committee of The Third People’s Hospital of Yibin (ethical approval numbers: 2022009). Inclusion criteria: ① Age 18-70 years; ② Primary liver cancer confirmed by clinical diagnosis or histopathology; ③ Eastern Cooperative Oncology Group (ECOG) performance status score of 0-1; ④ China Liver Cancer Staging (CNLC) stage Ⅱb-Ⅲb; ⑤ Adequate cardiopulmonary function; ⑥ Child-Pugh score ≤8 points; ⑦ At least one measurable tumor lesion according to the modified Response Evaluation Criteria in Solid Tumors (mRECIST) version 1.1. From November 1, 2021 to March 1, 2024, we recruited 61 patients, of whom 39 met the criteria. Firstly, all enrolled patients received TACE treatment. Approximately one week after the initial TACE procedure, 12 mg of anlotinib (adjusted according to tolerance) was administered orally on days 1-14, every 3 weeks; Simultaneously 200 mg of sintilimab was administered intravenously on day 1, every 3 weeks. After completing 2 cycles of treatment, efficacy evaluation was conducted according to the modified Response Evaluation Criteria in Solid Tumors (mRECIST) 1.1. The primary observation indicators of the study were objective response rate (ORR), and the secondary observation indicators were median progression-free survival (mPFS), disease control rate (DCR) and safety. Results: The ORR of this study was 76.9%, DCR was 94.9%, and mPFS was 9.2 months (95% CI: 2.317-16.083). 39 cases (100%) had grade 1-2 adverse reactions, 15 cases (38.5%) had grade 3 adverse reactions, 5 cases (12.8%) had grade 4 adverse reactions, and 1 patient died due to upper gastrointestinal bleeding. In the stage mainly treated with TACE combined with TKI and immunotherapy, the incidence of grade 3-4 adverse reactions was higher compared with the stage mainly treated with anlotinib combined with sintilimab. The vast majority of adverse reactions can be recovered through conventional treatment methods. Conclusion: TACE combined with anlotinib and sintilimab has a definite therapeutic effect and overall safety and controllability in the treatment of CNLC stage Ⅱb-Ⅲb liver cancer. This combination therapy may provide a new treatment model for CNLC stage Ⅱb-Ⅲb liver cancer patients. However, further exploration is needed to address the pain, vomiting, decreased appetite, liver function damage, upper gastrointestinal bleeding, and other issues caused by this treatment mode.
[Key words] Liver cancer; Transcatheter arterial chemoembolization; Sintilimab; Anlotinib; Targeted-immune combination therapy
肝癌在中国有着发病率高、分期晚、生存期短的特点。不断探索中晚期肝癌的治疗方案对延长中国肝癌患者的生存期具有重要意义。近年来的一些大型研究显示出靶免联合治疗在中晚期肝癌中的优势。例如,IMbrave150研究[1]显示,阿替利珠单抗+贝伐珠单抗与索拉非尼相比,提高了客观缓解率(objective response rate,ORR)(30% vs 11%),延长了中位无进展生存期(median progression-free survival,mPFS)(6.9个月 vs 4.3个月);ORIENT-32研究[2]显示,信迪利单抗+贝伐珠单抗类似物与索拉非尼相比,同样提高了ORR(21% vs 4%),延长了mPFS(4.6个月 vs 2.8个月)。与单药靶向治疗相比,靶免联合治疗进一步提高了中晚期肝癌的疗效。经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是中国肝癌的分期方案(China Liver Cancer Staging,CNLC)Ⅱb~Ⅲb期肝癌患者非手术治疗的主要手段之一。TACE可以快速杀死肿瘤细胞,释放出肿瘤抗原以激活免疫系统杀伤残存肿瘤细胞,但同时可能造成血管内皮生长因子(vascular endothelial growth factor,VEGF)表达上调,破坏肿瘤免疫微环境并促使肿瘤血管生成。信迪利单抗为程序性死亡蛋白-1(programmed death-1,PD-1)抗体,可以解除免疫抑制,使机体发挥更大的抗肿瘤效应。安罗替尼是一种多靶点的受体酪氨酸激酶抑制剂,可以抑制VEGF等受体,减少肿瘤血管生成的同时改善肿瘤免疫微环境。三者有效结合可能会进一步提高CNLC Ⅱb~Ⅲb期肝癌患者的疗效。因此,本研究计划在靶免联合治疗的基础上加入TACE治疗,旨在评估TACE联合安罗替尼及信迪利单抗治疗CNLC Ⅱb~Ⅲb期肝癌的近期疗效及安全性。
1 资料和方法
1.1 研究对象选择
本研究的设计和实施遵循《赫尔辛基宣言》,并通过宜宾市第三人民医院伦理委员会的审查(伦理批号:2022009)。纳入标准:① 年龄18~70岁;② 经临床诊断或组织学检查证实的原发性肝癌;③ 美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分为0~1分;④ CNLC Ⅱb~Ⅲb期;⑤ 心肺功能良好; ⑥ Child-Pugh分级为8分及以下;⑦ 至少有1个可以通过改进的实体瘤疗效评价标准(modified Response Evaluation Criteria in Solid Tumors,mRECIST)1.1测量的肿瘤病灶。2021年11月1日—2024年3月1日,共纳入61例患者,所有患者均在签署知情同意书后开始治疗。其中22例患者因选择其他的方案、严重并发症、中途退出等因素出组,最终39例患者完成治疗。
1.2 治疗方法
所有入选患者均于局部麻醉下行TACE治疗:常规消毒、铺巾,股动脉穿刺后分别插管至腹腔动脉、肝动脉、膈动脉等行血管造影检查,明确肿瘤位置、数目、大小、染色程度及供血情况,然后超选择性插管至肿瘤供血动脉后予以TACE治疗。术后1周左右予以口服安罗替尼12 mg(根据耐受情况调整用药剂量),第1~14天,每3周1次;同时予以静脉注射信迪利单抗200 mg,第1天,每3周1次。每完成2个周期治疗后根据mRECIST1.1进行疗效评估,同时监测患者的不良反应。治疗持续到疾病进展、出现无法忍受的不良反应、开始新的抗肿瘤治疗、患者拒绝继续治疗、失访、死亡或其他需要终止治疗的情况时停止。患者接受信迪利单抗及安罗替尼治疗的最长时间为24个月。
信迪利单抗有导致假进展的可能,在第1次发现疾病进展时,需继续治疗1~2个周期后复查,根据mRECIST1.1再次进行疗效评估。不良反应从患者首次TACE治疗时开始监测。TACE手术开始至术后1周内主要观察患者栓塞后综合征(指肿瘤和器官动脉栓塞后,因组织缺血坏死引起的疼痛、呕吐、发热、食欲下降等症状)、血常规、肝肾功能等情况,TACE术后3 d复查血常规、肝肾功能、电解质等(同一患者后续TACE不良反应监测的内容及时间点与第1次一致,如果患者出现意外事件或疾病发生重大变化时根据病情决定检测内容和检测时间)。每次安罗替尼及信迪利单抗治疗后1和3周随访不良反应,直至治疗结束后2个月。
1.3 确定样本量
使用PASS 15.0软件根据既往相关研究结果,ORR为77.4%[3],设定假设检验的Ⅰ类错误α为0.05,容许误差(δ)设为15%,计算得样本量为30例,设数据脱落率为30%,最终样本量为39例。
1.4 统计学处理
疗效根据mRECIST1.1评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。以CR+PR计算ORR,以CR+PR+SD计算疾病控制率(disease control rate,DCR)。药物的不良反应根据美国国家癌症研究所(National Cancer Institute,NCI)不良事件通用术语标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0版进行评价。使用GraphPad Prism 9.3.1软件制作疗效评估瀑布图;根据Kaplan-Meier方法估计mPFS并绘制生存曲线。
2 结 果
2.1 患者的一般资料
患者纳入和排除标准流程图见图1。最终纳入39例患者,平均年龄为57.33岁,其中男性31例(79.5%),女性8例(20.5%);乙肝病毒感染患者32例(82.1%);肝硬化患者29例(74.4%);肝外转移21例(53.8%);血管侵犯20例(51.3%)。Child-Pugh肝功能分级B级21例(53.8%);肿瘤最大径线超过5 cm者31例(79.5%),超过10 cm者17例(43.5%,表1)。
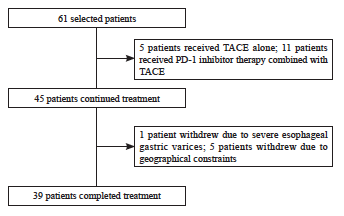
图1 患者纳入和排除标准流程图
Fig. 1 Flowchart of patient inclusion and exclusion criteria

2.2 疗 效
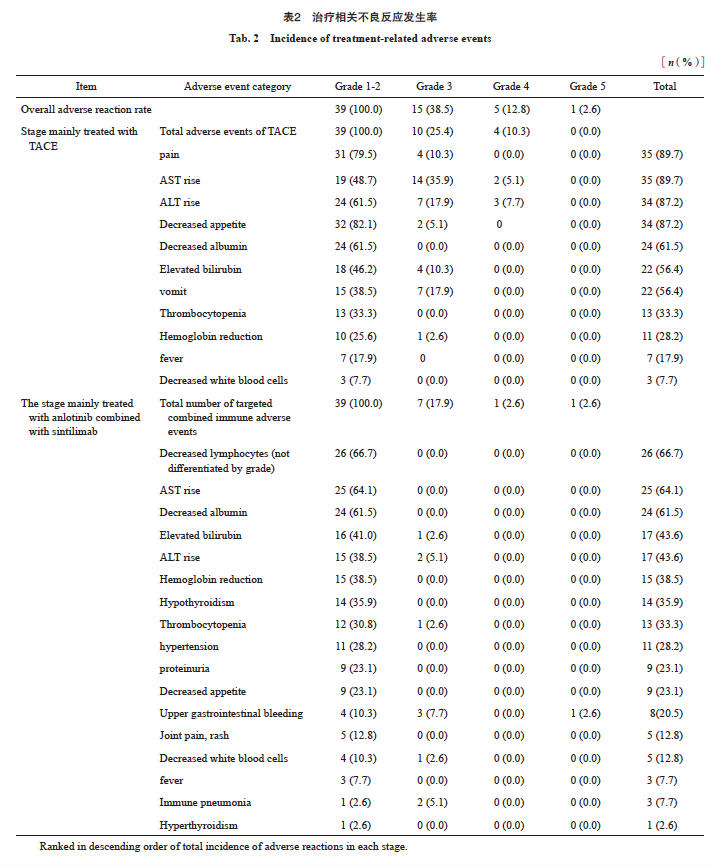
本研究39例患者中,CR 2例(5.1%), PR 28例(71.8%),SD 7例(17.9%),PD 2例(5.1%),客观缓解30例(76.9%),疾病控制37例(94.9%)。mPFS为9.2个月(95% CI:2.317~16.083,图2、3)。TACE治疗前后疗效对比见图4。
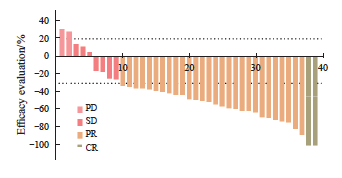
图2 TACE+安罗替尼+信迪利单抗方案疗效评估
Fig. 2 Efficacy evaluation of the TACE combined with anlotinib and sintilimab regimen
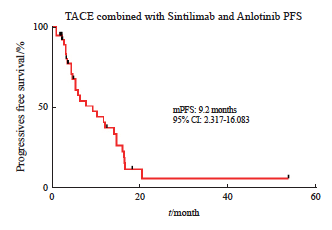
图3 TACE+安罗替尼+信迪利单抗方案的PFS
Fig. 3 PFS of the TACE combined with anlotinib and sintilimab regimen
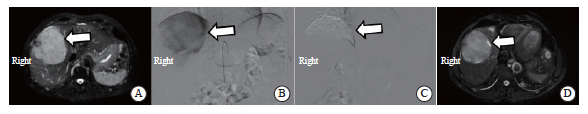
图4 TACE治疗前后疗效对比
Fig. 4 Comparison of therapeutic effects before and after TACE treatment
A: Before treatment, the upper abdominal MRI showed the condition of the tumor lesion (indicated by the arrow); B: Intraoperative hepatic angiography with TACE showed significant tumor staining; C: Postoperative TACE imaging shows disappearance of tumor staining; D: One month after TACE surgery, the upper abdominal MRI showed that most of the tumor lesions were necrotic (indicated by the arrow).
2.3 不良反应
在TACE联合安罗替尼及信迪利单抗治疗的整个过程中,39例(100%)患者均出现过1~2级不良反应,15例(38.5%)患者至少出现过1次3级不良反应,5例(12.8%)患者至少出现过1次4级不良反应,1例(2.6%)患者因上消化道出血导致死亡。
在以TACE联合治疗为主与以单纯靶免联合治疗为主的不同阶段中,两者1~2级不良反应的发生率均为100%。前者不良反应以疼痛、肝功能损伤和食欲减退为主,分别占89.7%、89.7%和87.2%,后者以淋巴细胞降低、肝功能损伤和白蛋白降低为主,分别占66.7%、64.1%和61.5%。在以TACE联合治疗为主的阶段,3级及以上不良反应中以肝功能损伤及栓塞后综合征为主,未发现致死性不良反应。在以安罗替尼联合信迪利单抗治疗为主的阶段,3级及以上不良反应中以上消化道出血占比最高(7.7%),其中1例患者因上消化道出血导致死亡(表2)。
3 讨 论
无论是2008年以来索拉非尼应用于肝癌的治疗[4],还是自2017年以来单药免疫治疗或靶免联合治疗的应用[1-2,5-6],新的治疗方案相较于传统化疗,均减少了不良反应并延长了患者生存时间。但是目前中国肝癌每年死亡人数仍趋近每年发病人数[7],所以仍需不断探索新的肝癌治疗方案。
对于CNLC Ⅱb~Ⅲb期的肝癌患者,TACE是主要治疗手段之一[8]。TACE一方面可以引起肿瘤缺血、坏死,从而控制肿瘤生长;另一方面,坏死的肿瘤细胞可以暴露更多的肿瘤抗原,激活肿瘤免疫细胞,发挥机体免疫效应杀死肿瘤细胞。此时加用免疫检查点抑制剂,可以更大程度地激活机体免疫效应,发挥抗肿瘤作用。信迪利单抗是一种人源IgG4单克隆抗体,可结合PD-1,从而阻断PD-1与其配体-1/2(programmed death ligand-1/2,PD-L1/2)的相互作用,帮助恢复内源性抗肿瘤T细胞应答[9]。信迪利单抗作为PD-1单抗的代表性药物之一,不仅在各实体瘤中有着不错的疗效,而且价格便宜,可及性好。
TACE治疗虽然疗效显著,但仍存在潜在风险。TACE术后肿瘤缺血、缺氧导致VEGF等表达水平上调,从而促进肿瘤血管的生成并导致肿瘤免疫微环境的改变,诱导肿瘤复发、转移[10]。多靶点抑制剂安罗替尼可有效地抑制血管内皮生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR1)、VEGFR2、VEGFR3、血小板衍生生长因子受体β(platelet-derived growth factor receptors β,PDGFRβ)、c-Kit(一种由c-Kit基因编码的受体酪氨酸激酶)等因子,减少肿瘤血管生成和重塑已生成的肿瘤血管,从而起到抗肿瘤作用[11]。
在TACE术后,使用安罗替尼联合信迪利单抗治疗肝癌。一方面诱导肿瘤微血管退化,同时降低无灌注血管的比例并减少剩余血管的渗漏。另一方面,增加肿瘤微环境中树突状细胞的活化,两种治疗相结合后进一步放大抗肿瘤免疫效应。此外,二者联合还可增强细胞毒性CD8+ T细胞的抗肿瘤作用[12]。安罗替尼与PD-1抑制剂在肺癌、软组织肉瘤、胰腺癌、头颈部肿瘤中均显示出良好的疗效及安全性[13-16]。在肝癌中,也有学者进行了相关的探索。韩春等[17]和Chen等[18]研究显示,安罗替尼联合PD-1抑制剂治疗晚期肝癌的ORR分别为23.1%和42.9%,AK105-203研究[19]显示,派安普利单抗联合安罗替尼治疗Ⅰb/Ⅱ期肝癌的ORR为31.0%,mPFS为8.8个月。安罗替尼联合PD-1单抗在肝癌患者中已有尝试,但ORR相对较低。
本研究中,TACE术后予以安罗替尼联合信迪利单抗治疗CNLC Ⅱb~Ⅲb期的肝癌患者, ORR为76.9%、mPFS为9.2个月,优于单纯靶免治疗[1-2,17-19]。分析原因可能是加入TACE治疗后,肿瘤缺血性坏死导致肿瘤细胞裂解增多,暴露出更多肿瘤抗原。加入PD-1抑制剂,解除“免疫刹车”使得暴露的肿瘤抗原与抗体结合,激活机体免疫系统对肿瘤细胞的杀伤。同时加入多靶点酪氨酸激酶抑制剂,抑制肿瘤血管生成,并使异常的肿瘤血管正常化,重塑了肿瘤免疫微环境,进一步增强了免疫治疗的抗肿瘤作用。
安全性方面,3级及以上的不良反应发生率为53.9%,主要发生在前期以TACE联合安罗替尼及信迪利单抗为主的治疗中,以肝功能损伤和栓塞后综合征为主,但通过保肝、止吐、止痛等对症治疗可以缓解。在以安罗替尼联合信迪利单抗治疗为主的阶段中,3级及以上的不良反应发生率明显下降,主要集中在上消化道出血、肝功能损伤、免疫性肺炎等方面。其中1例(2.6%)患者因上消化道出血死亡,不排除与安罗替尼相关;2例(5.1%)患者因严重免疫性肺炎停用信迪利单抗;高血压11例(28.2%)、蛋白尿9例(23.1%)均为1~2级不良反应,可自行好转;本研究未观察到免疫性皮肤反应、免疫性心肌炎等不良反应。该方案需要警惕上消化道出血和免疫性肺炎的发生。靶免联合治疗前建议完善胃肠镜、胸部CT、肺功能、动脉血气分析等检查,以尽可能地避免严重的不良反应。
本研究存在一定的局限性:本研究属于Ⅱ期单臂研究,入组病例少,观察时间短,其疗效还需大型Ⅲ期临床研究验证,另外患者的OS是否获益也不清楚。
综上所述,在TACE联合安罗替尼及信迪利单抗治疗CNLC Ⅱb~Ⅲb期肝癌中,近期疗效确切、不良反应可控。
第一作者:
童刚,硕士研究生,住院医师。
通信作者:
胡钧文,本科,副主任医师,肿瘤科副主任。
作者贡献声明:
童刚:协助TACE治疗,主要收集并整理数据,统计分析,撰写论文;华杨:主要完成TACE治疗;彭薇:主要完成靶免联合治疗;赵桔:协助数据收集、随访;胡钧文:论文设计把关,数据质量控制,论文修改。
[参考文献]
[1] GALLE P R, FINN R S, QIN S K, et al. Patient-reported outcomes with atezolizumab plus bevacizumab versus sorafenib in patients with unresectable hepatocellular carcinoma (IMbrave150): an open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2021, 22(7): 991-1001.
[2] REN Z G, XU J M, BAI Y X, et al. Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2-3 study[J]. Lancet Oncol, 2021, 22(7): 977-990.
[3] WU J Y, YIN Z Y, BAI Y N, et al. Lenvatinib combined with anti-PD-1 antibodies plus transcatheter arterial chemoembolization for unresectable hepatocellular carcinoma: a multicenter retrospective study[J]. J Hepatocell Carcinoma, 2021, 8: 1233-1240.
[4] LLOVET J M, RICCI S, MAZZAFERRO V, et al. Sorafenib in advanced hepatocellular carcinoma[J]. N Engl J Med, 2008, 359(4): 378-390.
[5] EL-KHOUEIRY A B, SANGRO B, YAU T, et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial[J]. Lancet, 2017, 389(10088): 2492-2502.
[6] CHENG A L, QIN S K, IKEDA M, et al. Updated efficacy and safety data from IMbrave150: atezolizumab plus bevacizumab vs. sorafenib for unresectable hepatocellular carcinoma[J]. J Hepatol, 2022, 76(4): 862-873.
[7] 郑荣寿, 陈 茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3): 221-231.
ZHENG R S, CHEN R, HAN B F, et al. Cancer incidence and mortality in China, 2022[J]. Chin J Oncol, 2024, 46(3): 221-231.
[8] 中华人民共和国国家卫生健康委员会医政司. 原发性肝癌诊疗威廉亚洲博彩公司 (2024年版)[J]. 中国实用外科杂志, 2024, 44(4): 361-386.
Bureau of Medical Administration, National Health Commission of the People’s Republic of China.Guideline for diagnosis and treatment of hepatocellular carcinoma (2024 edition)[J]. Chin J Pract Surg, 2024, 44(4): 361-386.
[9] HOY S M. Sintilimab: first global approval[J]. Drugs, 2019, 79(3): 341-346.
[10] 古 曦, 刘 畅, 刘双双, 等. 肝癌患者TACE术治疗前后血清VEGF、bFGF、HIF-1α水平变化及其临床意义[J]. 标记免疫分析与临床, 2019, 26(4): 546-549.
GU X, LIU C, LIU S S, et al. Changes of serum VEGF, bFGF and HIF-1α levels in patients with liver cancer before and after TACE and their clinical significances[J]. Labeled Immunoass Clin Med, 2019, 26(4): 546-549.
[11] 中国医师协会肿瘤医师分会, 中国临床肿瘤学会血管靶向治疗专家委员会, 中国抗癌协会肿瘤靶向治疗专业委员会,等. 盐酸安罗替尼治疗晚期肺癌中国专家共识(2023年版)[J]. 中国肿瘤临床与康复, 2023, 30(2): 67-78.
Chinese Association for Clinical Oncologists, Expert Committee of Vascular Targeted Therapy of Chinese Society of Clinical Oncology, Cancer Targeted Therapy Professional Committee of China Anti-Cancer Association. Chinese expert consensus on anlotinib hydrochloride for advanced lung cancer (2023 version)[J]. Chin J Clin Oncol Rehabil, 2023, 30(2): 67-78.
[12] KASHYAP A S, SCHMITTNAEGEL M, RIGAMONTI N, et al. Optimized antiangiogenic reprogramming of the tumor microenvironment potentiates CD40 immunotherapy[J]. Proc Natl Acad Sci USA, 2020, 117(1): 541-551.
[13] HAN X, GUO J, LI L Y, et al. Sintilimab combined with anlotinib and chemotherapy as second-line or later therapy in extensive-stage small cell lung cancer: a phase Ⅱ clinical trial[J]. Sig Transduct Target Ther, 2024, 9: 241.
[14] SUN X, XU J, XIE L, et al. Effectiveness and tolerability of anlotinib plus PD-1 inhibitors for patients with previously treated metastatic soft-tissue sarcoma[J]. Int J Gen Med, 2022, 15: 7581-7591.
[15] LIU H N, PAN D, YAO Z Y, et al. Efficacy and safety of gemCitabine/nab-paclitaxel combined with anlotinib and PD-1 inhibitors as a first-line treatment for advanced pancreatic cancer[J]. Int Immunopharmacol, 2024, 139: 112635.
[16] JIANG J Y, WU B, SUN Y, et al. Anlotinib reversed resistance to PD-1 inhibitors in recurrent and metastatic head and neck cancers: a real-world retrospective study[J]. Cancer Immunol Immunother, 2024, 73(10): 199.
[17] 韩 春, 叶斯斯, 李 娟, 等. 安罗替尼联合PD-1单抗(AK105)治疗13例晚期转移性肝细胞肝癌的疗效及安全性评价[J]. 解放军医学院学报, 2020, 41(9): 868-871.
HAN C, YE S S, LI J, et al. A preliminary study on effect and safety of anlotinib combined with anti-PD-1 antibody (AK105) in treatment of advanced hepatocellular carcinoma[J]. Acad J Chin PLA Med Sch, 2020, 41(9): 868-871.
[18] CHEN X F, LI W, WU X F, et al. Sintilimab plus anlotinib as first-line therapy in patients (pts) with advanced hepatocellular carcinoma (aHCC)[J]. J Clin Oncol, 2021, 39(15_suppl): e16146.
[19] HAN C, YE S S, HU C H, et al. Clinical activity and safety of penpulimab (anti-PD-1) with anlotinib as first-line therapy for unresectable hepatocellular carcinoma: an open-label, multicenter, phase Ⅰb/Ⅱ trial (AK105-203)[J]. Front Oncol, 2021, 11: 684867.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















前往app查看评论内容
4 0 举报