Circ Res 重庆医科大学附属儿童医院童超团队揭示胎盘滋养细胞外泌体来源Neprilysin触发子痫前期高血压的分子机制
2025-05-07 论道心血管 论道心血管 发表于陕西省
该研究解析了血管新生失衡的关键调控节点,通过“转录因子-效应蛋白-信号通路”调控中的可干预环节,为血管新生紊乱相关心血管疾病的靶向治疗提供了新的理论依据与潜在干预靶点。
血管新生是维持组织稳态与修复的核心生理过程,其动态平衡对心血管健康至关重要。失衡的血管新生可诱发多种心血管疾病:过度激活可能导致糖尿病视网膜病变等增殖性病变,而新生不足则与心肌梗死、下肢缺血等缺血性疾病密切相关。生理性血管新生依赖VEGF和Notch信号的精密协作。在此过程中,转录因子作为核心调控枢纽,通过时空特异性的基因表达重编程,精确指导血管网络的形成与重塑。因此,揭示关键转录因子的作用网络及调控机制,为开发靶向促血管/抗血管疗法提供新策略,对突破当前临床治疗困境具有重要价值。
2025年4月29日,上海交通大学医学院瑞金医院/上海市高血压研究所李晓东/高平进教授团队在Circulation Research杂志上在线发表题为“Endothelial KLF15/VASN Axis Inhibits Angiogenesis via Activation of Notch1 Signaling”的研究论文,揭示了转录因子KLF15通过转录激活内皮细胞关键因子VASN表达,进而特异性激活Notch1信号通路并抑制血管新生的分子互作机制。该研究解析了血管新生失衡的关键调控节点,通过“转录因子-效应蛋白-信号通路”调控中的可干预环节,为血管新生紊乱相关心血管疾病的靶向治疗提供了新的理论依据与潜在干预靶点。

研究团队基于前期KLF15调控血管稳态的研究基础,通过内皮细胞RNA-Seq通路富集分析,发现KLF15与血管新生信号通路密切相关。为明确其功能,研究者构建腺病毒过表达系统和内皮细胞特异性KLF15敲除小鼠,在体外新生实验与体内视网膜血管新生中均证实KLF15负向调控血管新生。为深入解析分子机制,采用多组学整合策略将RNA-Seq、ATAC-Seq和ChIP-Seq上调的基因交集分析,筛选锁定VASN为KLF15的关键下游效应分子。KLF15通过其保守DNA结构域特异性识别VASN启动子区域,协同染色质开放状态,显著增强VASN的转录活性及其蛋白水平。
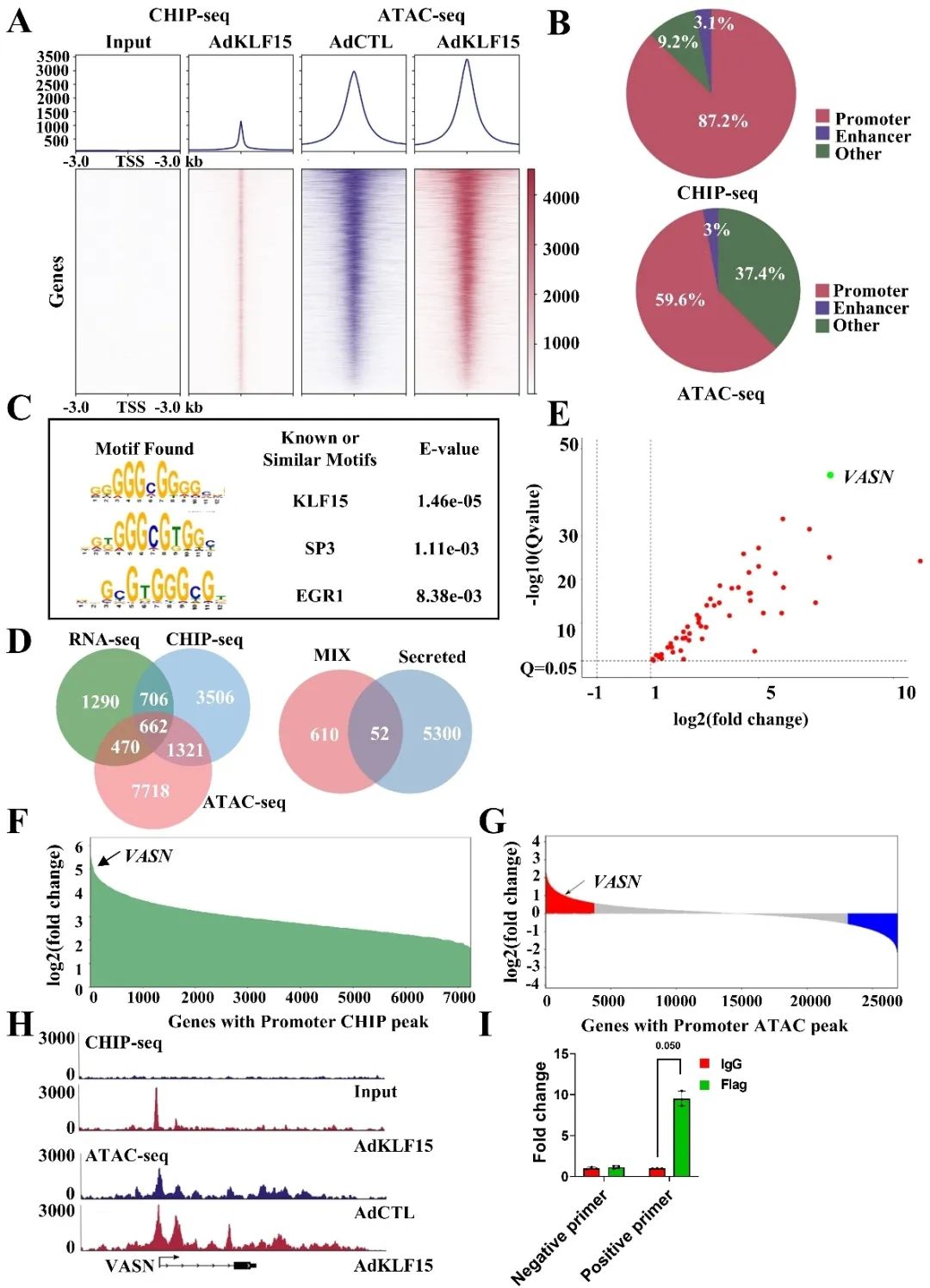
进一步研究表明,VASN同样具备抑制内皮细胞血管新生能力,且Dll4诱导的Notch1信号激活依赖VASN表达。在内皮细胞特异性KLF15敲除小鼠中,VASN的过表达可逆转视网膜血管新生亢进表型,该效应可被Notch1信号通路特异性抑制剂显著阻断。此外,内皮细胞特异性VASN敲除小鼠表现出与KLF15敲除小鼠一致的视网膜血管新生表型。机制上,VASN通过其EGF-like结构域与Notch1受体结合并相互作用,增强Notch1胞内结构域的表达及下游靶基因的转录激活,从而抑制内皮细胞增殖、迁移及血管出芽。值得注意的是,外源性的重组VASN蛋白及其EGF-like结构域衍生肽段均能有效激活Notch1信号通路并抑制血管新生。
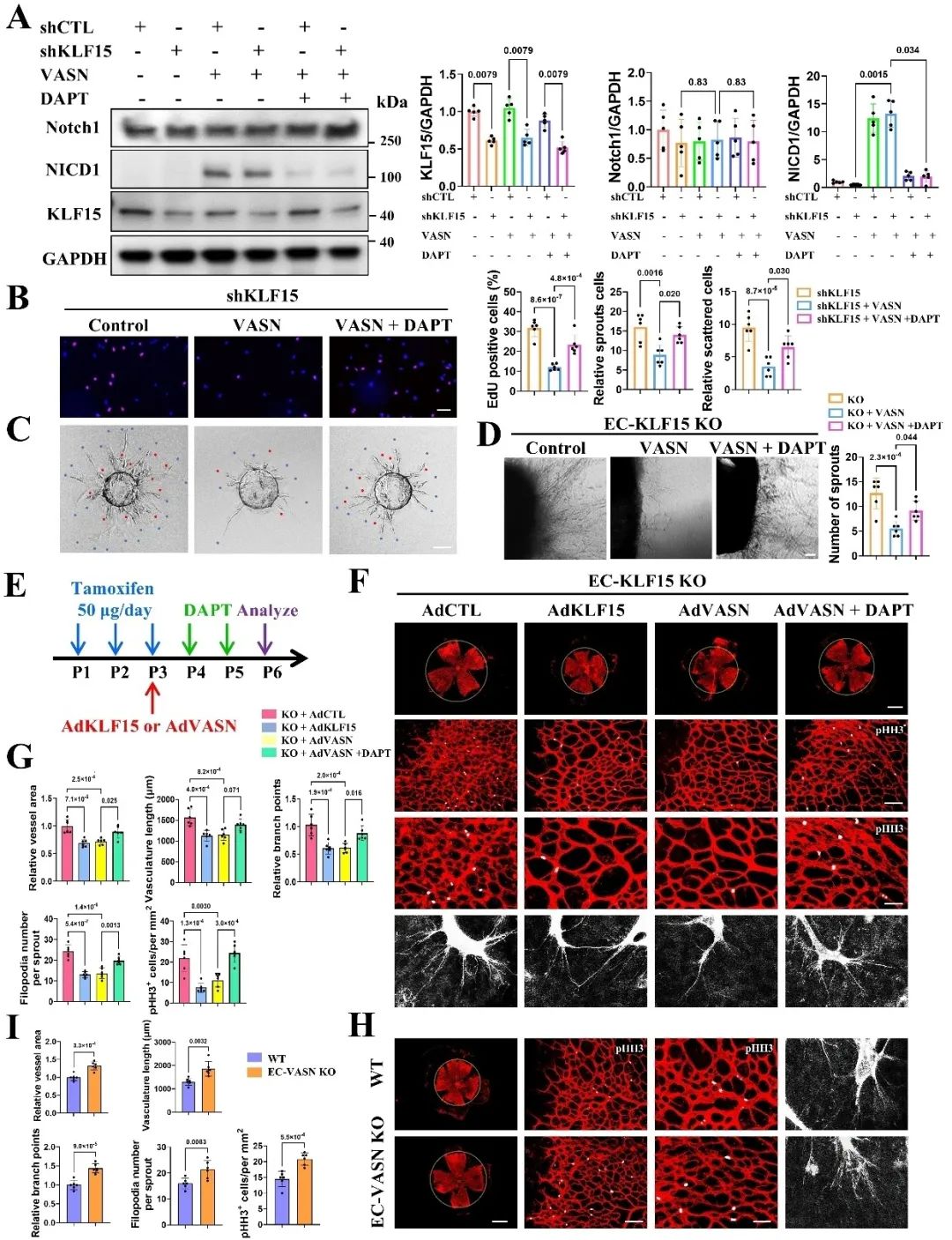
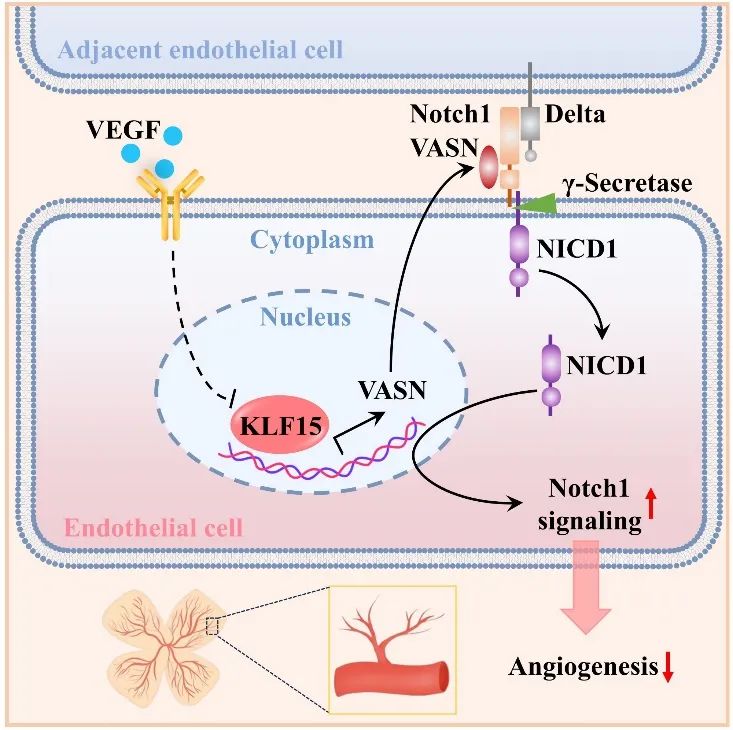
综上所述,本研究首次揭示了KLF15/VASN轴作为血管新生调控的分子枢纽。转录因子KLF15通过重编程驱动VASN的转录激活,后者作为Notch1信号的特异性分子伴侣,通过EGF-like结构域介导Notch1受体的高效激活,进而抑制血管新生的关键机制。该信号轴实现了血管新生的精准时空调控,其干预策略兼具靶向特异性和调控多维性,为精准治疗血管新生紊乱相关心血管疾病提供了新思路。
上海交通大学医学院瑞金医院/上海市高血压研究所李晓东副研究员和高平进教授为该论文的共同通讯作者,张佳、赵佳佳和周寒诞硕士为该论文的共同第一作者。该研究得到了国家重点研发计划和国家自然科学基金等项目的支持。
原文链接:
https://www.ahajournals.org/doi/epub/10.1161/CIRCRESAHA.124.325494
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言














#血管新生# #Klf15#
25 举报