【综述】|工智能在胃癌诊疗和患者预后预测中的应用现状及未来展望
昨天 中国癌症杂志 中国癌症杂志 发表于上海
本文将重点综述DL在胃癌诊断、疗效评估和预后预测中的应用现状及未来发展方向。
[摘要] 胃癌是全球范围内高发的恶性肿瘤之一,具有起病隐匿、早期诊断困难、进展期预后不良等特点。传统诊断技术受主观因素影响较大,且在准确率和效率方面存在局限,难以满足精准医学的临床需求。近年来,人工智能(artificial intelligence,AI)技术,尤其是基于深度学习(deep learning,DL)的快速发展,为胃癌的精准诊疗带来了全新的机遇。AI辅助胃镜诊断可显著提升病变检出率及诊断效率,AI驱动的影像组学模型可精准预测肿瘤浸润深度、淋巴结及腹膜转移情况,而AI辅助病理学系统的应用则可以显著提高诊断的准确率和效率。此外,结合多组学数据的AI模型在化疗和靶向治疗反应预测以及个体化预后评估方面亦展现出巨大潜力。然而,AI技术在胃癌领域的临床转化仍面临诸多挑战,包括数据标准化不统一、模型泛化能力不足及算法可解释性较弱等问题。因此,本文系统综述AI技术在胃癌诊断、疗效评估及预后预测方面的最新研究进展,深入探讨当前技术所面临的核心挑战,并展望未来AI在胃癌精准诊疗中的发展趋势,以期推动AI技术的广泛应用和临床转化,最终实现胃癌诊疗的精准化和个体化,改善患者的临床预后。
[关键词] 人工智能;胃癌;深度学习;诊断;预后
[Abstract] Gastric cancer remains one of the most prevalent and lethal malignancies worldwide, characterized by an insidious onset, challenges in early detection, and a poor prognosis in advanced stages. Conventional diagnostic approaches are often constrained by subjective interpretation and inherent limitations in accuracy and efficiency, rendering them insufficient to meet the demands of precision medicine. In recent years, the rapid advancement of artificial intelligence (AI), particularly deep learning (DL)-based techniques, has opened new avenues for the precise diagnosis and management of gastric cancer. Emerging evidence suggests that AI-assisted endoscopic systems significantly enhance lesion detection rates and diagnostic efficiency, while AI-driven radiomics models offer precise predictions of tumor invasion depth, lymph node involvement, and peritoneal metastasis. Additionally, AI-powered pathology analysis has markedly improved both diagnostic accuracy and efficiency. Moreover, integrative AI models leveraging multi-omics data have demonstrated great potential in predicting responses to chemotherapy and targeted therapies, as well as facilitating personalized prognostic assessments. However, despite these promising advancements, the clinical implementation of AI in gastric cancer remains hindered by challenges such as the lack of standardized datasets, limited model generalizability, and insufficient algorithm interpretability. This review systematically synthesized the latest advancements in AI applications for gastric cancer diagnosis, treatment response evaluation, and prognostic prediction. Furthermore, it critically examined key technical challenges in current AI methodologies and explored future directions in AI-driven precision medicine for gastric cancer. By addressing these challenges, we aimed to foster the widespread adoption and clinical translation of AI technologies, ultimately advancing precision oncology and improving patient outcomes.
[Key words] Artificial intelligence; Gastric cancer; Deep learning; Diagnosis; Prognosis
2022年全球癌症统计数据[1]显示,胃癌是全球第5大常见恶性肿瘤和癌症相关死亡原因,每年新增病例约97万,死亡病例约66万。研究[2]显示,早期胃癌患者5年生存率超过90%,而进展期胃癌仅在10%以下。由于大部分胃癌早期没有明显的症状和体征,患者在确诊时已经进入晚期,导致整体疗效较差。胃癌早期诊断与治疗面临诸多挑战:现有影像学和内镜技术在胃癌临床分期中的准确率有限,尤其在早期分期方面存在差异;在同一肿瘤组织内可能会出现多种子细胞群体,这些子细胞群体在分子基因学异常及肿瘤微环境等方面存在差异,严重限制了胃癌的精准病理学诊断;此外,肿瘤耐药性、微环境复杂性及患者免疫功能低下等问题也会进一步影响疗效。因此,早期规范化诊疗对改善患者预后至关重要。
随着人工智能(artificial intelligence,AI)在医疗领域的广泛应用,特别是在胃癌的诊断和预后预测方面,AI展现出巨大的潜力[3-4]。相比传统机器学习(machine learning,ML),深度学习(deep learning,DL)具有强大的特征学习能力、层次化表示和对大数据的适应性[5]。DL是ML的特殊类型,通过多层神经网络模拟人脑信息处理方式,能够自动从大量数据中学习特征,超越传统ML的表现(图1)。常用的DL模型包括深度神经网络、卷积神经网络(convolutional neural network,CNN)、图神经网络、残差网络、生成对抗网络及Transformer架构等[6]。本文将重点综述DL在胃癌诊断、疗效评估和预后预测中的应用现状及未来发展方向。
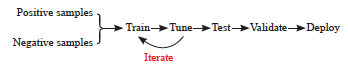
图1 DL模型开发与优化流程
Fig.1 DL model development and optimization process
1 AI在胃癌诊断和分期预测中的应用
1.1 AI在胃内病灶内镜诊断中的应用
在临床实践中,由于病变性质差异和内镜医师水平的限制,部分胃癌患者可能在内镜检查中被遗漏。近年来,AI算法在消化内镜领域快速发展。2024年,中国首次发布《上消化道内镜人工智能系统临床应用专家共识(2023,武汉)》[7]。2024年美国消化内镜协会对AI在内镜检查和胃肠病学中的应用发布10条共识声明[8]。这些威廉亚洲博彩公司 /共识推动了AI辅助内镜检查的标准化和同质化,提高了内镜检查的效率和诊断准确率。
内镜检查包括白光内镜(white-light endoscopy,WLE)、放大内镜、放大内镜联合窄带成像技术(magnifying endoscopy with narrow-band imaging,ME-NBI)和超声内镜等[9]。传统内镜学基于特征工程的ML算法,其流程包括图像采集、肿瘤分割、特征提取及模型训练与验证,用于胃癌诊断。相比之下,DL中的CNN通过多层神经网络进行整个图像序列的端到端输出,自动提取图像中的高级特征,从而识别复杂模式,实现更高效的诊断[10](图2)。 Du等[11]利用多模态数据融合(WLE结合弱放大染色内镜)构建的模型,可实时处理视频并进行诊断,显著增强内镜医师与AI的交互,改善患者预后。在辅助诊断测试中,低年资内镜医师在AI的辅助下与专家表现相当(84.50% vs 89.00%,P=0.121),同时大幅缩短诊断时间(30.67 min vs 65.17 min,P<0.05)。该研究反映出AI技术在提高诊断效率和精度方面的巨大潜力。
1.1.1 胃癌风险人群检测
胃癌的发生与遗传、特定的饮食习惯、幽门螺杆菌(Helicobacter pylori,Hp)感染等紧密相关[12]。一项前瞻性队列研究[13]显示,与内镜医师相比,AI辅助内镜不但可在实时视频中提高慢性萎缩性胃炎的诊断率(35.8% vs 24.6%),而且中、重度萎缩判断的准确率也明显提高。随后,该团队又纳入1 131例接受胃镜检查的患者进行嵌入式病例对照研究,结果显示,AI模型诊断慢性萎缩性胃炎的灵敏度(84.02% vs 62.72%)、特异度(97.04% vs 81.95%)、准确率(90.53% vs 72.34%)和Kappa值(0.852 vs 0.558)均优于内镜医师组[14]。AI的应用有助于医师迅速且精确地检测和诊断胃癌,帮助患者及时治疗。
WHO将Hp定义为一级致癌物,Hp感染在胃癌的发生、发展中发挥重要作用[15]。Yang等[16]开发的胃镜图像AI辅助综合分析系统,收集了516例患者的6 270张WLE图像,带入14种CNN模型进行训练,EfficientNetB7模型对区分Hp与非Hp感染的预测准确率达83.33%,受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)为0.909 6。随后,Nakashima等[17]进行了单中心前瞻性队列研究,分别对AI辅助胃镜诊断有无Hp感染及除菌是否成功进行研究,结果发现AI辅助WLE诊断Hp感染的灵敏度和特异度分别为86.7%和86.7%,AUC为0.956。另外,基于图像增强胃镜的AI诊断Hp不同感染状态的准确率优于基于WLE的AI,且与有经验的内镜医师相当。这些研究结果突显出AI在提高胃癌早期诊断效率和准确率方面的潜力,但仍需进一步优化算法,提升泛化能力,以应对不同临床环境下的挑战。
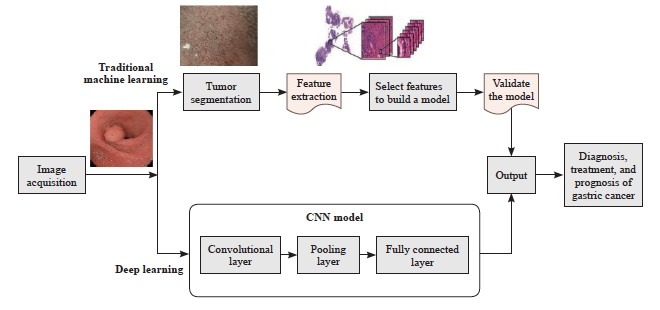
图2 内镜图像分析:ML vs DL
Fig. 2 Endoscopic image analysis: ML vs DL
1.1.2 良恶性分类预测
早期胃癌的病变不明显,有时与胃炎难以区分。Horiuchi等[18]使用ME-NBI获取的1 492张早期胃癌图片和1 078张胃炎图片进行基于CNN模型的训练,在由151张早期胃癌图片和107张胃炎图片组成的独立测试集中取得0.853的准确率,其灵敏度、特异度、阳性预测值和阴性预测值分别为0.954、0.710、0.823和0.917,平均阅片速度为51.83张/s。Yang等[16]在胃内良/恶性病变的二分类研究中,EfficientNetB7模型的AUC为0.994 3,对早期胃癌预测的准确率为91.76%,而对良性病变预测的准确率为99.52%。然而,这些模型在应对复杂病变和较为细微的内镜下特征时,仍有进一步优化的空间。
1.1.3 胃癌浸润深度评估
肿瘤浸润深度是决定胃癌患者接受内镜切除或外科手术的关键标准,但内镜检查对其判断的准确率较低。通过DL可显著提升内镜医师在肿瘤浸润深度诊断中的能力。北京大学肿瘤医院开展的一项多中心、前瞻性、实时竞赛性的比较诊断性研究[19],用ENDOANGEL系统与内镜医师通过比较内镜视图实时答题,在早期胃癌浸润深度和分化状态的预测中,ENDOANGEL的表现与内镜医师相当,专家、高级和初级内镜医师的平均诊断时间分别为2.22、2.53和2.42 h,而ENDOANGEL为1.60 h。AI在提高内镜检查效率的同时,也能为医师节省时间。Gong等[20]基于DL模型训练5 017张内镜图像预测胃癌浸润深度,该模型的胃内病变检出率为95.6%,胃癌浸润深度预测的准确率为89.2%(病变限于黏膜或黏膜下层)。Uema等[21]开发基于AI的超声内镜辅助诊断模型,用于诊断早期胃癌的浸润深度。在诊断性能方面,AI模型的准确率、灵敏度和特异度(74.1%、73.1%和75.0%)与内镜专家的实时诊断相当(75.5%、79.1%和72.2%)。综上所述,AI在胃癌浸润深度评估中具有显著的临床应用前景,尤其在提高诊断准确率和工作效率方面展现出特有优势。
1.1.4 AI在胃镜质量控制方面的应用
AI通过执行多项任务来确保消化内镜检查期间的质量控制,如监测盲区、记录检查时间、自动识别解剖结构和评估黏膜清洁度等。充足的检查时间是提高内镜质量的方法之一,对于接受内镜检查的患者,推荐将AI辅助内镜检查时间作为质量控制工具[7]。2016年,欧洲胃肠内镜学会(European Society of Gastrointestinal Endoscopy,ESGE)提出首次诊断性胃镜检查时间至少7 min[22]。在一项收集49个胃镜视频作为模型训练和验证数据集的研究[23]中,AI辅助系统在93.7%的视频中正确预测开始时间,在97.1%的视频中正确预测结束时间,且AI辅助组胃镜程序的平均检查时间显著长于对照组(5.03 min vs 4.24 min,P<0.001)。完整观察整个胃是保证诊断性胃镜质量的前提[7],ESGE提出胃镜检查至少要获得10张胃图像[23]。在一项随机对照研究[23]中,AI辅助系统能以90.4%的准确率监测盲点,它和对照组分别分析153和150例患者,AI辅助组的盲点率低于对照组(5.86% vs 22.46%,P<0.001)。AI在提高内镜检查质量和减少盲区方面具有显著优势,能够为患者提供更加全面和精确的检查。
1.2 AI辅助计算机体层成像(computed tomography,CT)在胃癌分期和诊断腹膜转移中的应用
准确的治疗前分期是决定局部晚期胃癌患者综合治疗方案选择的关键环节,CT诊断胃癌淋巴结转移的准确率仅为50%~70%[24]。影像组学与AI结合是目前热门的交叉学科研究领域,DL能够从图像序列中直接提取和学习高级特征,实现复杂图像模式的识别和分类,可用于胃癌的临床分期及诊断腹膜转移等。
1.2.1 胃癌T分期预测
胃癌浸润深度在腹部增强CT上表现为胃壁局部或弥漫性增厚,且病变的密度与正常胃壁不同。即使是经验丰富的放射科医师,其诊断早期胃癌的准确率范围也仅为51.6%~91.5%[25]。 Wang等[26]开发了一种基于CNN的CT影像组学模型,用于区分T2期和T3/4期胃癌,该模型的AUC达到0.899。Zeng等[27]通过基于ResNet101的AI分类器模型区分早期(T1期)和T2期胃癌的准确率为91.4%~94.6%,AUC为0.993(95% CI:0.984~1.000)。此外,该模型还展示出区分T1a和T1b期的能力,准确率为62.3%~88.6%。以上研究为未来基于CT图像中可解释特征提升胃癌早期分期诊断精度的研究奠定了基础。
1.2.2 胃癌N分期预测
淋巴结转移是影响胃癌患者预后的关键因素。对于肿瘤局限于黏膜或黏膜下层且无淋巴结转移的患者,内镜下切除可避免根治性手术和淋巴结清扫引起的并发症。然而,12.3%~19.6%的早期胃癌患者确诊时已有淋巴结转移[28],若仅行内镜下切除原发性病灶,可能延误治疗。因此,精准的治疗前淋巴结状态评估至关重要。多项研究[29-31]表明,通过分析从CT图像的动脉期或门静脉期提取的特征,并建立影像组学模型,可有效地预测胃癌的淋巴结转移情况。
Dong等[30]基于来自国内外6个研究中心的730例局部晚期胃癌患者的术前CT图像,利用CNN方法构建预测淋巴结转移数量的DL影像组学列线图(DL radiomics nomogram,DLRN)模型,结果显示,DLRN在训练集、内部验证集和外部验证集中的C指数分别为0.821、0.822和0.797,优于临床N分期方法,并与患者总生存期(overall survival,OS)显著相关。Zheng等[32]回顾性收集1 205例局部晚期胃癌患者新辅助化疗后的CT图像,基于Transformer框架的DL网络(DL network,DLN)预测胃癌患者新辅助治疗后的淋巴结转移,DLN采用全肿瘤的3D分析全面反映肿瘤的异质性与动态变化。在所有验证集中,DLN模型表现出较强的泛化能力和预测准确率,其灵敏度显著高于临床模型(78.5% vs 67.0%)。以上研究结果为基于CT影像组学DL模型预测胃癌淋巴结转移的精准评估提供了有力支持,也与既往相关研究的结论相互印证。
1.2.3 胃癌腹膜转移预测
腹膜是晚期胃癌最常见的复发、转移部位,约20%的患者在术前或术中诊断有腹膜转移,而这些转移在CT图像上经常被忽视[33]。伴有腹膜转移患者的中位生存期仅3~6个月,5年生存率低于2%[34]。因此,腹膜转移的早期诊断对于胃癌患者的治疗和预后至关重要。
Jiang等[35]开发了基于DL的术前CT预测晚期胃癌隐匿性腹膜转移的模型PMetNet,共纳入1 978例多中心回顾性数据,分为训练集(1 225例)、外部验证集1(504例)和外部验证集2(249例),PMetNet在训练集中的灵敏度为83.7%,特异度为92.8%,AUC为0.955,在外部验证集1和2中的AUC分别为0.946和0.920,显著优于传统临床病理学指标(AUC:0.51~0.63)。此外,该团队在此基础上开发出同时多任务DL模型,通过术前CT图像实时预测腹膜复发风险和无病生存期(disease-free survival,DFS),在预测效率和准确率上进一步提高,为胃癌精准诊疗提供了新方法[36]。Chen等[37]结合蛋白质组学和ML开发了预测胃癌腹膜转移的模型,共纳入25例患者,通过TMT标记蛋白质组学筛选出641种差异蛋白,并利用XGBoost筛选出10种与腹膜转移密切相关的核心蛋白特征。模型在交叉验证中的平均AUC为0.83,表现出良好的预测性能,为胃癌精准治疗和预后分层提供了重要依据。尽管这些研究创新性地采用多模态方法,突破传统单一数据源的限制,有效地提升了腹膜转移的早期预测能力,但仍存在回顾性病例数据和样本量小等问题,可能导致模型表现受样本选择偏倚的影响,限制其在不同临床群体中的普适性和可靠性。
1.3 AI在胃癌病理学诊断中的应用
在肿瘤诊断和亚型分类中,组织病理学评估至关重要。传统的病理学检测不仅费时且存在一定的主观性,随着AI在病理学领域的快速发展,数字病理学正迎来变革。《人工智能辅助胃部组织病理学诊断的数据采集和标注专家共识》[38]规范数据采集与质量控制流程,为AI辅助胃癌病理学诊断技术的发展提供了有力支持。Wang等[39]开发了临床组织病理学图像评估基础(clinical histopathology imaging evaluation foundation,CHIEF)模型,用于提取系统性癌症评估的病理学成像特征,CHIEF模型在19个解剖部位的60 530张全切片图像上预训练,并在32个独立数据集上验证,结果显示,CHIEF模型在癌细胞检测、肿瘤起源识别、分子特征预测及预后预测中显著优于现有DL方法,性能提升最高达36.1%。
Song等[40]基于CNN技术在1 500例胃癌患者的H-E染色病理学切片中,建立了一个用于辅助临床病理学诊断的AI系统,该系统能够快速定位可疑的肿瘤区域,在试运行阶段表现出稳定的诊断性能(AUC为0.986,准确率为0.873,灵敏度为0.996,特异度为0.806)。此外,在真实世界测试中,该系统显著提高了初级病理科医师诊断的准确率和稳定性。刘洋等[41]采用AI辅助显微镜对胃癌患者新辅助化疗前后人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达进行评估,发现与视觉评估相比,AI评估结果与金标准的一致率更高(0.766 vs 0.853,0.773 vs 0.876)。浙江大学近期发布的视觉与语言模型融合的人机交互AI病理学助手OmniPT,可覆盖分类、分割、检测等多类型诊断任务,并支持病理学报告一键生成,该系统可在1~3 s内精准锁定病灶区域,并在数十类癌种中取得95%以上的诊断准确率[42]。AI诊断系统不仅能够提高病理学诊断效率,还可增强不同水平医师的诊断准确率。然而,要实现病理学诊断系统在临床中的全面应用,仍需解决系统适应性、数据质量和可解释性等关键问题。
2 AI在胃癌疗效和患者预后预测中的应用
胃癌患者的治疗反应和预后不仅与肿瘤分期有关,还取决于肿瘤异质性和表观遗传分子特征。通过分析大量临床和基因组数据,AI可个体化预测OS、肿瘤倍增时间、治疗反应及预后,为患者寻求更精准高效的治疗策略。
2.1 胃癌的疗效预测
不同肿瘤的药物敏感性和耐药性存在显著差异,深入了解其机制对优化治疗至关重要。Zhao等[43]探讨了如何利用DL算法预测肿瘤何时会对化疗产生耐药性。Wang等[44]基于8个溶酶体相关基因利用转录组数据及单细胞测序数据,构建了AI辅助胃癌疗效预测模型,该模型能够准确预测胃癌患者化疗或免疫治疗效果(AUC为0.92),从而改善患者的预后。Gao等[45]提出一种增量监督对比学习模型iSCLM,整合预处理CT和H-E染色活检图像,能准确预测化疗效果并优化新辅助化疗方案(AUC:0.846~0.876)。根据模型预测结果,接受iSCLM建议组与拒绝iSCLM建议组的5年生存率分别为48.6%和35.6%(P=0.005)。
多组学数据融合分析是未来肿瘤诊疗的重要趋势。北京大学肿瘤医院沈琳教授团队收集了多中心429例HER2阳性胃癌患者的数据,包括临床信息、影像与病理学图像及其结构化报告,基于此数据集开发AI驱动的精准预测模型MuMo,该模型在抗HER2靶向治疗及联合免疫治疗反应预测中表现优异(AUC为0.821和0.914),并有效地将患者分为高风险组和低风险组,从而提供更有针对性的治疗建议[46]。尽管研究展示出多组学数据与AI结合在复杂疾病中的应用前景,但肿瘤的异质性和AI算法存在的偏差,可能会影响预测的准确率。需要通过持续学习和引入更多的数据类型来进一步完善、优化模型。
转化治疗已成为部分局部晚期胃癌患者的选择,但仅有20%~40%的患者能从新辅助化疗中获益[47]。因此,精准识别潜在获益患者,避免不必要的治疗相关不良反应具有重要临床意义。Li等[48]基于CT影像中肿瘤及周围组织特征,构建了可有效预测Ⅱ/Ⅲ期胃癌患者DFS和化疗反应的影像组学模型。Tan等[49]则建立了delta影像组学模型,可有效预测晚期胃癌患者的化疗反应,最佳AUC达0.83。Gao等[31]开发的影像组学模型通过评估肿瘤中的调节性T细胞浸润情况,能够预测并识别在程序性死亡蛋白-1(programmed death-1,PD-1)单抗治疗中可能发生超进展的患者。尽管目前影像组学模型在化疗反应预测中表现优异,但仍缺乏特异性生物标志物来精确识别获益患者,应当继续探索能够与影像学特征相结合的生物标志物。
2.2 胃癌患者的预后预测
Zhou等[50]基于DL 构建多模态注意力的虚拟多重免疫荧光(multiplexed immunofluorescence,mIF)染色系统来预测胃癌中多种与OS相关的生物标志物。该系统建立在端到端生成CNN之上,以自发荧光和4’,6-二脒基-2-苯基吲哚载玻片作为输入,生成胃癌相关生物标志物的mIF染色,结果显示,与CD3低表达组相比,CD3高表达组患者的OS显著更长(P <0.001),CD20、CD8、PD1和综合阳性评分与较长的OS显著相关,而CD163和FOXP3表现出较短OS的趋势。Cai等[51]通过DL建立了1 699例胃癌患者基因表达数据集的预后模型GPSGC,探索与GPSGC相关的生存调控机制和治疗靶点,结果显示,转化生长因子β1和血管内皮生长因子的基因集与GPSGC风险评分和不良预后显著相关,可作为胃癌患者的潜在治疗靶点。
HER2在多种组织(包括胃肠道)中表达,能够促进细胞增殖并抑制凋亡。有研究[52]表明,HER2过表达是胃癌进展的重要因素,并且与患者预后不良相关。刘洋等[41]用AI辅助显微镜评估新辅助化疗(neoadjuvant chemotherapy,NAC)前后胃癌病理学标本,结果显示,在非病理学完全缓解(pathologic complete response, pCR)的患者中,NAC后HER2表达下调者的5年OS率和DFS率均高于上调者(56.7% vs 30.5%,P<0.001;56.1% vs 23.0%,P<0.001);在非pCR的HER2 2+/3+患者中,表达下调者的5年OS率和DFS率优于表达无变化者(56.7% vs 33.5%,P=0.003;56.1% vs 32.0%,P=0.002)。此外,Ma等[53]基于门脉期增强CT的影像组学成功预测HER2高表达,训练集和验证集的AUC分别为0.84和0.78。尽管AI模型在评估一致性方面表现出色,但由于HER2表达的异质性,AI可能无法完全捕捉到不同患者的个体差异。
3 AI联合组学数据在胃癌中的研究进展
AI与多组学数据的融合能够为胃癌诊疗研究提供多维度的分析框架。表1从应用场景、AI方法及核心成果3个维度,对不同技术路径下的研究进展进行归纳,旨在为将来多模态数据融合研究提供方向性参考。
4 AI在胃癌全程化管理中的挑战和未来发展前景
AI在医学中的应用面临数据标准化不足的挑战。不同国家和医学中心的数据解读标准各异,缺乏统一的质量评价机制,导致AI模型在跨数据集应用中的效果有限。此外,数据源的异构性和质量差异可能引发算法偏差,影响研究结论的可靠性[55]。为此,建议尽早制定标准化协议,采用先进算法筛选数据,确保数据共享安全性和合规性,推动AI在医学领域的普及和优化。
医学AI模型的泛化性问题同样突出。由于训练数据缺乏多样性,模型在不同人群中的适用性有限。实现模型的跨群体泛化需要多机构、多中心合作,整合多元数据集,构建公平且普适的预测模型[55]。此外,AI的复杂性和决策过程的不可解释性削弱了医师和患者对其的信任,并带来伦理和法律风险[56]。为此,各国正通过法律规范机构由于自身利益或专利原因使算法不透明等行为,同时推动科学研究解决“黑箱”问题。
AI技术的快速发展为医学研究带来了前所未有的伦理挑战。尽管2024年《赫尔辛基宣言》在多个方面进行改进[57],但对AI相关的伦理问题并未进行详细讨论,如AI技术发展引发数据隐私、算法偏见和临床决策透明性等伦理问题。未来,需要更多关于AI伦理的具体指导,保障所有参与者的权益。
当前在胃癌领域,AI凭借其在复杂数据集成和处理中的优势,展现出广阔的应用前景。通过高效整合多模态数据,AI为精准预测模型的构建奠定了基础。通过医工结合和多中心研究,AI与医师协作将覆盖胃癌管理全周期,优化诊疗流程,显著改善患者预后。
5 小 结
尽管AI在胃癌诊断、疗效评估和预后预测中展现出巨大潜力,但AI本身无法替代医师,当前在临床中只能起到辅助性作用,并且存在诸多问题有待解决。AI的广泛应用需要依赖临床医师和计算机专家的紧密合作。特别是在基层医院的推广,AI技术有望提升胃癌诊疗的同质化和标准化水平,从而改善患者预后。
第一作者:
彭东阁,博士研究生在读。
通信作者:
卢宁,博士研究生,主任医师、教授,中国人民解放军新疆军区总医院肿瘤科主任。
作者贡献声明:
彭东阁:文献收集和整理,综述撰写;万子叶,卢宁:综述撰写指导和修改。
[参考文献]
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[2] 中华人民共和国国家卫生健康委员会医政医管局. 胃癌诊疗威廉亚洲博彩公司 (2022年版)[J]. 中华消化外科杂志, 2022, 21(9): 1137-1164.
Bureau of Medical Administration, National Health Commission of the People’s Republic of China. Standardization for diagnosis and treatment of gastric cancer (2022 edition)[J]. Chin J Dig Surg, 2022, 21(9): 1137-1164.
[3] HUANG S G, YANG J, SHEN N, et al. Artificial intelligence in lung cancer diagnosis and prognosis: current application and future perspective[J]. Semin Cancer Biol, 2023, 89: 30-37.
[4] LADBURY C, AMINI A, GOVINDARAJAN A, et al. Integration of artificial intelligence in lung cancer: rise of the machine[J]. Cell Rep Med, 2023, 4(2): 100933.
[5] PEI Q, LUO Y N, CHEN Y Y, et al. Artificial intelligence in clinical applications for lung cancer: diagnosis, treatment and prognosis[J]. Clin Chem Lab Med, 2022, 60(12): 1974-1983.
[6] PEREZ-LOPEZ R, LALEH N G, MAHMOOD F, et al. A guide to artificial intelligence for cancer researchers[J]. Nat Rev Cancer, 2024, 24(6): 427-441.
[7] 中华医学会消化内镜学分会大数据协作组. 上消化道内镜人工智能系统临床应用专家共识(2023, 武汉)[J]. 中华消化内镜杂志, 2024, 41(2): 85-96.
Big Data Collaboration Group, Digestive Endoscopology Branch of Chinese Medical Association. Expert consensus on clinical application of upper gastrointestinal endoscopic artificial intelligence system (2023, Wuhan)[J]. Chin J Dig Endosc, 2024, 41(2): 85-96.
[8] AI TASK FORCE A S G E, PARASA S, BERZIN T, et al. Consensus statements on the current landscape of artificial intelligence applications in endoscopy, addressing roadblocks, and advancing artificial intelligence in gastroenterology[J]. Gastrointest Endosc, 2025, 101(1): 2-9. e1.
[9] 中国抗癌协会胃癌专业委员会,中国医师协会外科医师分会上消化道外科医师委员会,中国人群健康风险管理协作组-胃癌专业组. 中国人群胃癌风险管理公众威廉亚洲博彩公司 (2023版)[J]. 中华医学杂志, 2023, 103(36): 2837-2849.
Chinese Gastric Cancer Association of Chinese Anti-Cancer Association, Chinese Society of Upper Gastrointestinal Surgeons of Chinese Medical Doctor Association, Chinese Health Risk Management Collaboration-Gastric Cancer Group. Chinese guideline on risk management of gastric cancer in the general public (2023 edition)[J]. Natl Med J China, 2023, 103(36): 2837-2849.
[10] 王士旭, 柯 岩, 楚江涛, 等. 基于数据增强和混合神经网络的人工智能技术在上消化道内镜检查部位识别中的应用[J]. 中华消化内镜杂志, 2023, 40(3): 189-195.
WANG S X, KE Y, CHU J T, e t a l . Appli ca t i on o f artificial intelligence based on data enhancement and hybrid neural network to site identification during esophagogastroduodenoscopy[J]. Chin J Dig Endosc, 2023, 40(3): 189-195.
[11] DU H L, DONG Z H, WU L L, et al. A deep-learning based system using multi-modal data for diagnosing gastric neoplasms in real-time (with video)[J]. Gastric Cancer, 2023, 26(2): 275-285.
[12] 国家卫生健康委员会医疗应急司. 胃癌筛查与早诊早治方案(2024年版)[J]. 中华肿瘤杂志, 2024, 46(10): 915-916.
Department of Medical Emergency Response, National Health Commission. Screening, early diagnosis and treatment of gastric cancer (2024 edition)[J]. Chin J Oncol, 2024, 46(10): 915-916.
[13] ZHAO Q C, CHI T Y. Deep learning model can improve the diagnosis rate of endoscopic chronic atrophic gastritis: a prospective cohort study[J]. BMC Gastroenterol, 2022, 22(1): 133.
[14] ZHAO Q C, JIA Q, CHI T Y. Deep learning as a novel method for endoscopic diagnosis of chronic atrophic gastritis: a prospective nested case-control study[J]. BMC Gastroenterol, 2022, 22(1): 352.
[15] Infection with Helicobacter pylori[M]//IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. IARC monographs on the evaluation of carcinogenic risks to humans volume 61: schistosomes, liver flukes and Helicobacter pylori. Lyon (FR): international agency for research on cancer, 1994: 177-240.
[16] YANG R X, ZHANG J L, ZHAN F S, et al. Artificial intelligence efficiently predicts gastric lesions, Helicobacter pylori infection and lymph node metastasis upon endoscopic images[J]. Chin J Cancer Res, 2024, 36(5): 489-502.
[17] NAKASHIMA H, KAWAHIRA H, KAWACHI H, et al. Endoscopic three-categorical diagnosis of Helicobacter pylori infection using linked color imaging and deep learning: a single-center prospective study (with video)[J]. Gastric Cancer, 2020, 23(6): 1033-1040.
[18] HORIUCHI Y, AOYAMA K, TOKAI Y, et al. Convolutional neural network for differentiating gastric cancer from gastritis using magnified endoscopy with narrow band imaging[J]. Dig Dis Sci, 2020, 65(5): 1355-1363.
[19] WU L L, WANG J, HE X Q, et al. Deep learning system compared with expert endoscopists in predicting early gastric cancer and its invasion depth and differentiation status (with videos)[J]. Gastrointest Endosc, 2022, 95(1): 92-104.e3.
[20] GONG E J, BANG C S, LEE J J, et al. Deep learning-based clinical decision support system for gastric neoplasms in realtime endoscopy: development and validation study[J]. Endoscopy, 2023, 55(8): 701-708.
[21] UEMA R, HAYASHI Y, KIZU T, et al. A novel artificial intelligence-based endoscopic ultrasonography diagnostic system for diagnosing the invasion depth of early gastric cancer[J]. J Gastroenterol, 2024, 59(7): 543-555.
[22] BISSCHOPS R, AREIA M, CORON E, et al. Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) quality improvement initiative[J]. Endoscopy, 2016, 48(9): 843-864.
[23] YU T, HU H Y, ZHANG X S, et al. Real-time multi-label upper gastrointestinal anatomy recognition from gastroscope videos[J]. Appl Sci, 2022, 12(7): 3306.
[24] LOCH F N, BEYER K, KREIS M E, et al. Diagnostic performance of Node Reporting and Data System (Node-RADS) for regional lymph node staging of gastric cancer by CT[J]. Eur Radiol, 2024, 34(5): 3183-3193.
[25] KIM D J, HYUNG W J, PARK Y K, et al. Accuracy of preoperative clinical staging for locally advanced gastric cancer in KLASS-02 randomized clinical trial[J]. Front Surg, 2022, 9: 1001245.
[26] WANG Y, LIU W, YU Y, et al. Prediction of the depth of tumor invasion in gastric cancer: potential role of CT radiomics[J]. Acad Radiol, 2020, 27(8): 1077-1084.
[27] ZENG Q W, FENG Z F, ZHU Y Y, et al. Deep learning model for diagnosing early gastric cancer using preoperative computed tomography images[J]. Front Oncol, 2022, 12: 1065934.
[28] STANDARDS OF PRACTICE COMMITTEE A S G E, FORBES N, ELHANAFI S E, et al. American Society for Gastrointestinal Endoscopy guideline on endoscopic submucosal disp for the management of early esophageal and gastric cancers: summary and recommendations[J]. Gastrointest Endosc, 2023, 98(3): 271-284.
[29] JIN C, JIANG Y, YU H, et al. Deep learning analysis of the primary tumour and the prediction of lymph node metastases in gastric cancer[J]. Br J Surg, 2021, 108(5): 542-549.
[30] DONG D, FANG M J, TANG L, et al. Deep learning radiomic nomogram can predict the number of lymph node metastasis in locally advanced gastric cancer: an international multicenter study[J]. Ann Oncol, 2020, 31(7): 912-920.
[31] GAO X J, MA T T, CUI J L, et al. A radiomics-based model for prediction of lymph node metastasis in gastric cancer[J]. Eur J Radiol, 2020, 129: 109069.
[32] ZHENG Y L, QIU B J, LIU S L, et al. A transformer-based deep learning model for early prediction of lymph node metastasis in locally advanced gastric cancer after neoadjuvant chemotherapy using pretreatment CT images[J]. EClinicalMedicine, 2024, 75: 102805.
[33] YANG R, SU Y D, MA R, et al. Clinical epidemiology of peritoneal metastases in China: the construction of professional peritoneal metastases treatment centers based on the prevalence rate[J]. Eur J Surg Oncol, 2023, 49(1): 173-178.
[34] 中国抗癌协会胃癌专业委员会. 胃癌腹膜转移诊治中国专家共识(2023版)[J]. 中华胃肠外科杂志, 2023(8): 717-728.
Gastric Cancer Committee of China Anti Cancer Association. Chinese expert consensus on the diagnosis and treatment of peritoneal metastasis of gastric cancer (2023 edition)[J]. Chin J Gastrointest Surg, 2023(8): 717-728.
[35] JIANG Y M, LIANG X K, WANG W, et al. Noninvasive prediction of occult peritoneal metastasis in gastric cancer using deep learning[J]. JAMA Netw Open, 2021, 4(1): e2032269.
[36] JIANG Y M, ZHANG Z C, YUAN Q Y, et al. Predicting peritoneal recurrence and disease-free survival from CT images in gastric cancer with multitask deep learning: a retrospective study[J]. Lancet Digit Health, 2022, 4(5): e340-e350.
[37] CHEN Y Y, CAI G X, JIANG J J, et al. Proteomic profiling of gastric cancer with peritoneal metastasis identifies a protein signature associated with immune microenvironment and patient outcome[J]. Gastric Cancer, 2023, 26(4): 504-516.
[38] 《人工智能辅助胃部组织病理学诊断的数据采集和标注专家共识》编写组. 人工智能辅助胃部组织病理学诊断的数据采集和标注专家共识[J]. 中华病理学杂志, 2024, 53(9): 893-897.
Expert Committee of the Consensus on Data Acquisition and Annotation of Artificial Intelligence Assisted Gastric Histopathological Diagnosis. Expert consensus on data acquisition and annotation of artificial intelligence assisted gastric histopathological diagnosis [J]. Chin J Pathol, 2024, 53(9): 893-897.
[39] WANG X Y, ZHAO J H, MAROSTICA E, et al. A pathology foundation model for cancer diagnosis and prognosis prediction[J]. Nature, 2024, 634(8035): 970-978.
[40] SONG Z G, ZOU S M, ZHOU W X, et al. Clinically applicable histopathological diagnosis system for gastric cancer detection using deep learning[J]. Nat Commun, 2020, 11(1): 4294.
[41] 刘 洋, 胡奕炀, 刘月平, 等. 人工智能辅助技术在胃癌新辅助化疗患者HER2表达评估中的价值[J]. 中国癌症杂志, 2023, 33(4): 377-387.
LIU Y, HU Y Y, LIU Y P, et al. The value of artificial intelligence-assisted technology in HER2 assessmentof gastric cancer patients receiving neoadjuvant chemotherapy[J]. China Oncol, 2023, 33(4): 377-387.
[42] LUIK T T, ROSAS-BERTOLINI R, REITS E A J, et al. BIOMERO: a scalable and extensible image analysis framework[J]. Patterns (N Y), 2024, 5(8): 101024.
[43] ZHAO X Y, SINGHAL A, PARK S, et al. Cancer mutations converge on a collection of protein assemblies to predict resistance to replication stress[J]. Cancer Discov, 2024, 14(3): 508-523.
[44] WANG Q, LIU Y, LI Z Z, et al. Establishment of a novel lysosomal signature for the diagnosis of gastric cancer with invitro and in-situ validation[J]. Front Immunol, 2023, 14: 1182277.
[45] GAO P, XIAO Q, TAN H, et al. Interpretable multi-modal artificial intelligence model for predicting gastric cancer response to neoadjuvant chemotherapy[J]. Cell Rep Med, 2024, 5(12): 101848.
[46] CHEN Z F, CHEN Y, SUN Y, et al. Predicting gastric cancer response to anti-HER2 therapy or anti-HER2 combined immunotherapy based on multi-modal data[J]. Signal Transduct Target Ther, 2024, 9(1): 222.
[47] AL-BATRAN S E, HOMANN N, PAULIGK C, et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial[J]. Lancet, 2019, 393(10184): 1948-1957.
[48] LI J M, ZHANG C, WEI J, et al. Intratumoral and peritumoral radiomics of contrast-enhanced CT for prediction of diseasefree survival and chemotherapy response in stage Ⅱ/Ⅲ gastric cancer[J]. Front Oncol, 2020, 10: 552270.
[49] TAN J W, WANG L, CHEN Y, et al. Predicting chemotherapeutic response for far-advanced gastric cancer by radiomics with deep learning semi-automatic segmentation[J]. J Cancer, 2020, 11(24): 7224-7236.
[50] ZHOU Z X, JIANG Y M, SUN Z P, et al. Virtual multiplexed immunofluorescence staining from non-antibody-stained fluorescence imaging for gastric cancer prognosis[J]. EBioMedicine, 2024, 107: 105287.
[51] CAI W Y, DONG Z N, FU X T, et al. Identification of a tumor microenvironment-relevant gene set-based prognostic signature and related therapy targets in gastric cancer[J]. Theranostics, 2020, 10(19): 8633-8647.
[52] AJANI J A, D’AMICO T A, BENTREM D J, et al. Gastric cancer, version 2.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(2): 167-192.
[53] MA T T, CUI J L, WANG L W, et al. A multiphase contrastenhanced CT radiomics model for prediction of human epidermal growth factor receptor 2 status in advanced gastric cancer[J]. Front Genet, 2022, 13: 968027.
[54] SHIN J, LIM J S, HUH Y M, et al. A radiomics-based model for predicting prognosis of locally advanced gastric cancer in the preoperative setting[J]. Sci Rep, 2021, 11(1): 1879.
[55] ARORA A, ALDERMAN J E, PALMER J, et al. The value of standards for health datasets in artificial intelligence-based applications[J]. Nat Med, 2023, 29(11): 2929-2938.
[56] 张 潇, 周 辉, 何晶晶, 等. 数据治理法制化背景下中国临床研究数据收集和应用新考量[J]. 中华消化外科杂志, 2022(1): 89-92.
ZHANG X, ZHOU H, HE J J, et al. New consideration for data collection and application of clinical research under the background of ligalization of data administration in China[J]. Chin J Dig Surg, 2022(1): 89-92.
[57] RIBEIRO JUNIOR H L. AI ethics in medical research: the 2024 Declaration of Helsinki[J]. Lancet, 2024, 404(10467): 2048-2049.
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与williamhill asia 联系,williamhill asia 将立即进行删除处理。
在此留言

















胃癌是全球范围内高发的恶性肿瘤之一,具有起病隐匿、早期诊断困难、进展期预后不良等特点。
0 举报
#胃癌# #人工智能#
5 举报